
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
【答案】D
【解析】
各种离子的物质的量浓度均为![]() ,向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化,产生气体不可能是碳酸根离子或碳酸氢根离子;根据表中的离子,可推知是
,向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化,产生气体不可能是碳酸根离子或碳酸氢根离子;根据表中的离子,可推知是![]() 、
、![]() 在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有
在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有![]() ,若只含有氯离子和硝酸根离子,二者的浓度为
,若只含有氯离子和硝酸根离子,二者的浓度为![]() ,根据电荷守恒是不可能的,所以还含有阴离子
,根据电荷守恒是不可能的,所以还含有阴离子![]() ,由于总共含有5种离子,再根据电荷守恒可知还含有一种带有两个正电荷的
,由于总共含有5种离子,再根据电荷守恒可知还含有一种带有两个正电荷的![]() ,所以原溶液中含有的五种离子为:
,所以原溶液中含有的五种离子为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,
,
A.根据分析可知,溶液中一定不存在![]() 与
与![]() ,故A正确;
,故A正确;
B.生成无色气体为NO,反应的离子方程式为:![]() ,故B正确;
,故B正确;
C.原溶液中一定含有![]() ,故C正确;
,故C正确;
D.原溶液中含有的五种离子为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,含有2种阳离子、3种阴离子,故D错误;
,含有2种阳离子、3种阴离子,故D错误;
故选:D。


科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
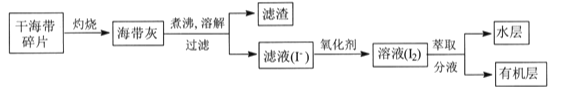
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=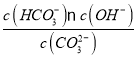 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“span>不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是海水淡化的常用方法,某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法错误的是( )
A.淡化过程中易在甲室形成水垢
B.淡化过程中戊室的电极反应式为:2Cl--2e-=Cl2↑
C.淡化过程中乙室和丁室中部分离子的浓度减小,淡水的出口为a、c
D.当甲室收集到标准状况下11.2L气体时,通过甲室阳膜的离子的物质的量一定为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
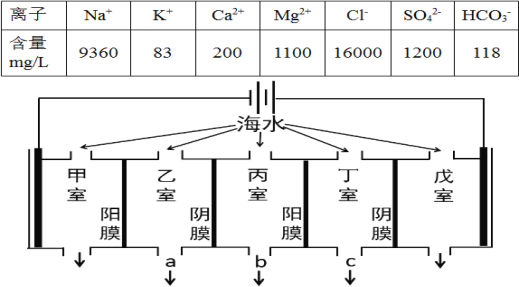
【题目】A、B、C、D四种物质之间有下图所示的转化关系。
已知:A是气体单质,C 是红棕色气体。
回答下列问题:
(1)写出C的化学式:________;
(2)在上图D→B的过程中,D表现出强_____(填“氧化性”或“还原性”);
(3)写出C→D转化的化学方程式__________________________________
(4)D→B的离子方程式_____________________________________________
(5)C 是红棕色气体,若A是气态氢化物,则A的电子式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,下列各溶液中有关微粒的物质的量浓度关系正确的是
时,下列各溶液中有关微粒的物质的量浓度关系正确的是![]()
![]()
A.向![]() 溶液中滴加NaOH溶液至恰好呈中性:
溶液中滴加NaOH溶液至恰好呈中性:![]()
B.![]() 溶液呈酸性:
溶液呈酸性:![]()
C.![]() 溶液与
溶液与![]() 溶液混合后的酸性溶液:
溶液混合后的酸性溶液:![]() COO
COO![]()
D.浓度均为![]() 的小苏打溶液与烧碱溶液等体积混合:
的小苏打溶液与烧碱溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
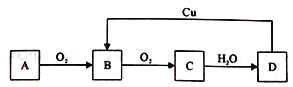
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A.盐酸的导电能力一定比醋酸的导电能力强
B.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生![]() 速率减小,
速率减小,![]() 体积减小
体积减小
C.相同温度下![]() 氨水
氨水![]() 的浓度比
的浓度比![]() 溶液
溶液![]() 的浓度小
的浓度小
D.![]() 氨水可以使酚酞试液变红,证明
氨水可以使酚酞试液变红,证明![]() 是弱碱
是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料。用6 mol·L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价)。装置如图所示(加热和夹持装置已略去)。
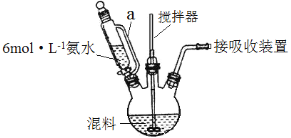
①滴液漏斗中a管的作用是________。
②实验室用14.8 mol·L-1浓氨水配制250 mL 6mol·L-1的氨水需要的仪器有胶头滴管、烧杯、玻璃棒、量筒、________。
③调节pH至6.5~9是为了促进柠檬酸电离。pH不能大于9的原因是______。
④用水浴加热的目的是__________。
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在_______(填仪器名称)中焙烧。
②焙烧需要在空气中进行的原因是__________。
③焙烧产生的气体是________。
(3)测定产品中锰的含量:准确称取0.1000 g的产品试样,加入足量浓盐酸溶液加热溶解,驱赶溶液中残留的Cl2,配成250 mL溶液。取25.00 mL溶液于锥形瓶中用0.02000 mol·L-1EDTA(Mn2+与EDTA按1:1络合)滴定,消耗EDTA溶液的体积V mL。样品中锰的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com