
【题目】下列说法中正确的是![]()
![]()
A.盐酸的导电能力一定比醋酸的导电能力强
B.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生![]() 速率减小,
速率减小,![]() 体积减小
体积减小
C.相同温度下![]() 氨水
氨水![]() 的浓度比
的浓度比![]() 溶液
溶液![]() 的浓度小
的浓度小
D.![]() 氨水可以使酚酞试液变红,证明
氨水可以使酚酞试液变红,证明![]() 是弱碱
是弱碱
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
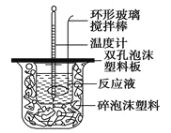
(1)烧杯间填满碎泡沫塑料的作用是______________;
(2)环形玻璃搅拌棒_______(填“能”或“不能”)用环形铁质搅拌棒代替,其原因是________;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:________。
Ⅱ.FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:X极:CH4+10OH-![]() 8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
A. 通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿挥发油是青蒿的活性成分(几乎不溶于水,可溶于乙醚,熔点156-157℃,对热不稳定,乙醚的沸点34.6℃),有抗菌、解热、止咳等作用。实验室从青蒿中提取青蒿挥发油的流程如图所示。
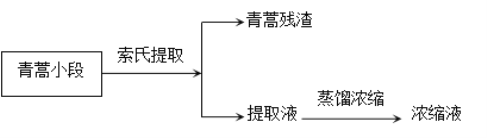
索氏提取装置如图所示,实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与青蒿小段接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿小段的连续萃取。回答下列问题:
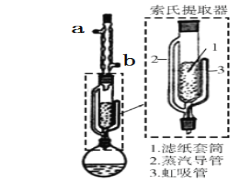
(1)实验时需将青蒿剪成1-2cm小段,放入滤纸套筒1中,剪成小段的目的是___,圆底烧瓶中加入乙醚为溶剂时,应不超过烧瓶容积的___。
(2)索氏提取器中滤纸套筒的高度(x)、套管内青蒿小段的高度(y)及虹吸管的高度(z)由大到小的顺序是___(用x、y、z回答),与常规的萃取相比,采用索氏提取器的优点是___。
(3)提取时球形冷凝管中冷水应从__(填“a”或“b”)管导入,提取液需经___(“常压”或“减压”)蒸馏法除去大部分溶剂,下列仪器在该蒸馏中需要用到的有___(填字母标号)。
A.直形冷凝管 B.球形冷凝管 C.锥形瓶 D.烧杯 E.温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
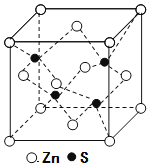
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,22.4 L CH2Cl2中含有碳原子数为NA
B.在溶有1molFe(OH)3的胶体中含有的胶粒数小于NA
C.常温下0.2 mol铝与足量浓硫酸反应,生成气体的分子数为0.3 NA
D.常温下向密闭容器内充入46 g NO2,容器中气体的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质。下列说法不正确的是( )
A.该反应是氧化还原反应
B.该反应的ΔH < 0
C.生成新物质的化学式为 Fe2S3
D.生成新物质的总能量低于反应物铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com