
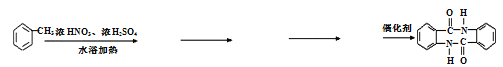
【题目】甲苯可用于合成治疗粘膜溃疡、创面等的镇痛药物苯佐卡因及食用香料F,其合成路线如下:
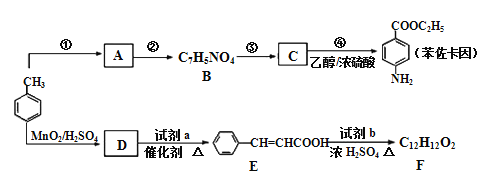
已知:
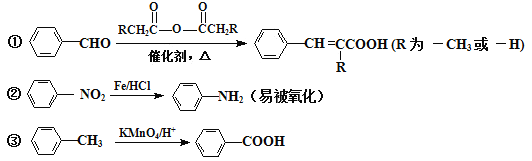
④苯环上发生取代反应规律:当苯环碳原子连有甲基时,主要在其邻位或对位上引入官能团;当苯环碳原子连有羧基时,主要在其间位上引入官能团。
请回答下列问题:
(1)B分子中含氧官能团的名称是_______;试剂a的结构简式为________。
(2)下列关于苯佐卡因合成路线的说法中错误的是________(填字母)
a.步骤①和②可以互换
b. 反应①、④属于取代反应
c.反应①的条件为酸性高锰酸钾溶液
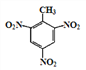
d.反应①除主要生成A外,还可能生成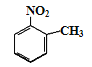 、
、
(3)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,b的化学名称是______,写出E与试剂b生成F的化学方程式__________。
(4)E有多种同分异构体,符合下列条件的有________种。
①苯环上有三个取代基;②能发生银镜反应,且1 mol该有机物生成4 mol Ag
写出其中一种核磁共振氢谱有4组吸收峰,且峰面积之比为1∶2∶2∶3的有机物的结构简式___________。
(5)参照上述合成路线及信息,根据已有知识,完善下列以甲苯为主要原料制备有机物(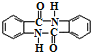 )的合成路线_________(无机试剂任选)。
)的合成路线_________(无机试剂任选)。
【答案】 羧基、硝基 ![]() ac 丙烯醇
ac 丙烯醇 ![]() 6
6 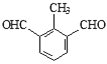
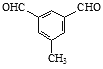 (任写一种即可)
(任写一种即可) 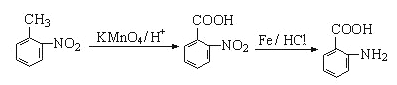
【解析】根据有机物官能团结构和性质特点,依据反应条件、已知信息和转化关系图借助于正推法或逆推法首先判断出有机物的结构简式,然后结合问题分析解答即可。
在反应④中,C与乙醇发生酯化反应生成苯佐卡因,则C应为![]() ,根据题给B的分子式为C5H7NO4可知B为
,根据题给B的分子式为C5H7NO4可知B为![]() ,由题给信息:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以A为
,由题给信息:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以A为![]() ;根据E的结构简式可知D生成E发生已知信息①中的反应,则D是 甲醛。根据E的结构简式和F的分子式以及反应条件可判断试剂b是醇,分子式为C3H6O。质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,则b的结构简式为CH2=CHCH2OH,所以F的结构简式为
;根据E的结构简式可知D生成E发生已知信息①中的反应,则D是 甲醛。根据E的结构简式和F的分子式以及反应条件可判断试剂b是醇,分子式为C3H6O。质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,则b的结构简式为CH2=CHCH2OH,所以F的结构简式为![]() 。
。
(1)根据B的结构简式可知B分子中含氧官能团的名称是羧基、硝基;根据已知信息①和D、E的结构简式可知试剂a的结构简式为![]() 。(2)a、因为当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以当步骤①和②互换时,先氧化成羧基,再取代则就不是对位而是间位,a错误;b、根据以上分析可知①、④均是取代反应,b正确;c、反应①为甲苯的硝化反应,试剂是浓硫酸和浓硝酸,c错误;d、根据题给信息,甲苯和与浓硝酸发生邻位取代或生成三硝基甲苯,d正确;答案选ac;(3)根据以上分析可知b的化学名称是丙烯醇,E与试剂b生成F的化学方程式为
。(2)a、因为当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位,所以当步骤①和②互换时,先氧化成羧基,再取代则就不是对位而是间位,a错误;b、根据以上分析可知①、④均是取代反应,b正确;c、反应①为甲苯的硝化反应,试剂是浓硫酸和浓硝酸,c错误;d、根据题给信息,甲苯和与浓硝酸发生邻位取代或生成三硝基甲苯,d正确;答案选ac;(3)根据以上分析可知b的化学名称是丙烯醇,E与试剂b生成F的化学方程式为![]() ;(4)①苯环上有3个取代基; ②能发生银镜反应,且1 mol该有机物生成4 mol Ag,说明含有2个醛基,说明3个取代基是甲基和2个醛基,在苯环上的位置有6种。写出其中一种核磁共振氢谱有4组吸收峰,且峰面积之比为1∶2∶2∶3的有机物的结构简式为
;(4)①苯环上有3个取代基; ②能发生银镜反应,且1 mol该有机物生成4 mol Ag,说明含有2个醛基,说明3个取代基是甲基和2个醛基,在苯环上的位置有6种。写出其中一种核磁共振氢谱有4组吸收峰,且峰面积之比为1∶2∶2∶3的有机物的结构简式为 或
或 。(5)采用逆推法,要合成
。(5)采用逆推法,要合成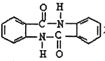 ,则要得到
,则要得到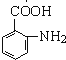 ,模仿流程中用甲苯到C的反应,不同的是在邻位取代,则流程图为
,模仿流程中用甲苯到C的反应,不同的是在邻位取代,则流程图为 。
。


科目:高中化学 来源: 题型:
【题目】关于溶解平衡的说法中,错误的是( )
A.溶解平衡的本质是结晶速率等于溶解速率
B.在不饱和溶液中,溶质的溶解速率小于结晶速率
C.在饱和溶液中,晶体的质量不改变,形状可能改变
D.当物质达到溶解平衡时,不改变外界条件,溶液的浓度也不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①菜籽油和氯化钠溶液 ②75%的医用酒精 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.过滤 萃取 分液
B.萃取 分液 蒸馏
C.分液 蒸馏 萃取
D.萃取 蒸馏 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
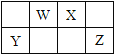
A. Z元素的最高价氧化物水化物的酸性强于Y
B. 由W元素形成的分子W2中存在三个共价键
C. 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定
D. 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18 e-两种微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物的性质相似。现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的PH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数;假设Zn2+的浓度为10-5mol/L时,已沉淀完全)。则下列说法不正确的是

A. 某废液中含Zn2+,沉淀对Zn2+以控制溶液pH的范围是(8,12 ) ,
B. 往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
C. 向1L 0.01mol/LZnCl2溶液中逐渐滴加NaOH溶液,当PH>6时Zn2+开始沉淀
D. 向1L 0.01mol/LZnCl2溶液中逐渐滴加NaOH溶液至PH=7,此时溶液中Zn2+的浓度为10-3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验HCl气体中是否混有Cl2 , 可采用的方法是( )
A.用干燥的蓝色石蕊试纸
B.用干燥的有色布条
C.将气体通入硝酸银溶液
D.用湿润的有色布条
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
A. 一定条件下某密闭容器盛2 mol N2与3 mol H2反应生成的NH3分子数为2NA
B. 25 ℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C. 一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
D. 1 L 0.1mol·L-1的NaHCO3溶液中HCO![]() 和CO
和CO![]() 的离子数之和为0.1NA
的离子数之和为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com