
【题目】实验室制备硝基苯,反应装置如图。下列对该实验的叙述错误的是

A.长玻璃管起冷凝回流作用
B.水浴加热其优点是受热均匀,便于控制温度
C.粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
D.洗涤后,用无水CaCl2干燥,然后过滤,得到纯硝基苯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氧化物的形式表示硅酸盐的组成,其中正确的是
A.钙沸石Ca(Al2Si3O10)·3H2O表示为Al2O3·CaO·3SiO2·3H2O
B.镁橄榄石Mg2SiO4表示为MgO·![]() SiO2
SiO2
C.正长石KAlSi3O8表示为K2O·Al2O3·3SiO2
D.高岭石Al2(Si2O5)(OH)4表示为Al2O3·2SiO2·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,水质优劣直接影响人体健康,水处理技术在生产、生活中应用广泛。聚合硫酸铁(PFS)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)和废铁屑为原料制取聚合硫酸铁([Fe2(OH)x(SO4)3-![]() ]m)的工艺流程如图:
]m)的工艺流程如图:
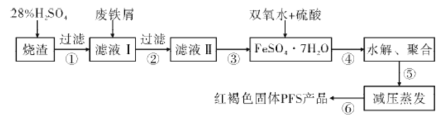
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______(填标号)。
a.容量瓶 b.烧杯 c.玻璃棒 d.分液漏斗
(2)废铁屑表面附有铁锈,铁锈的主要成分为______,步骤③的具体实验操作有____。
(3)水解、聚合要严控pH和温度。pH偏小时Fe3+水解程度弱,pH偏大时则______。写出水解、聚合反应生成PFS的化学方程式:_________。
(4)步骤⑥相对于常压蒸发,减压蒸发的优点是_________。
(5)污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质能作为沉淀剂的是_______(填标号)。
a.氨水 b.硫化氢气体 c.硫酸钠溶液 d.纯碱溶液
(6)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.5×10-3mol/L,c(Mg2+)=6.4×10-4mol/L,则此水的硬度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如图。
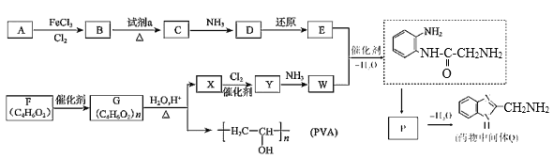
已知:①R-Cl+2NH3→R-NH2+NH4Cl
②R-NO2![]() R-NH2
R-NH2
③-NH2+![]()
(1)A的分子式是________。
(2)B→C是硝化反应,试剂a是________(填名称)。
(3)C→D转化的化学方程式是________。
(4)E的结构简式是________。
(5)F含有的官能团是________(填名称),与其含有相同官能团的同分异构体还有________种。
(6)G→X的化学方程式是________。
(7)W能发生缩聚反应,形成的高分子结构简式是________。
(8)P的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
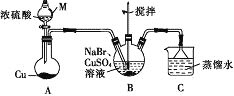
(1)仪器M的名称是________。
(2)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为______(填化学式)。
(3)B中发生反应的化学方程式为_______,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是_______(填标号)。
a.液溴 b.Na2SO4 c.铁粉 d.Na2S2O3
(4)下列关于过滤的叙述不正确的是_______ (填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁
b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(5)洗涤时,先用装置C中的吸收液清洗,其目的是_______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com