
【题目】常温下,在10 mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未两出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是( )
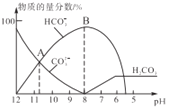
A.Kw(CO32-)的数量级为10-4
B.当溶液是中性时,溶液的总体积大于20 mL
C.在0.1 mol/L Na2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D.在B点所示的溶液中离子浓度最大的是HCO3-
【答案】D
【解析】
A. 根据图象可知当c(HCO3-)=c(CO32-)时,H2CO3的第二步电离平衡常数Ka2=c(H+)>10-11,碳酸根离子水解方程式:CO32-+H2O![]() HCO3-+OH-,当c(HCO3-)=c(CO32-)时,Kw(CO32-)水解平衡常数Kw(CO32-)
HCO3-+OH-,当c(HCO3-)=c(CO32-)时,Kw(CO32-)水解平衡常数Kw(CO32-)![]() ,Kw(CO32-)的数量级为10-4,A正确;
,Kw(CO32-)的数量级为10-4,A正确;
B. 当Na2CO3的物质的量与HCl的物质的量相等时,二者恰好反应产生NaCl和NaHCO3,加入的HCl体积是10 mL,此时溶液总体积为20 mL,NaHCO3是强碱弱酸酸式盐,HCO3-水解程度大于其电离程度,使溶液呈碱性,若要使pH=7,则HCl的物质的量要比Na2CO3的稍微多些,即加入的盐酸体积应大于10 mL,此时溶液的总体积大于20 mL,B正确;
C. 任何电解质溶液中都存在电荷守恒,①c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-);溶液中还存在物料守恒:②c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),将②带入①式,整理可得:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-),所以c(OH-)>c(H2CO3)+c(HCO3-)+c(H+),C正确;
D. B点溶液中溶质为NaHCO3,钠离子不水解,HCO3-会发生水解反应、电离作用而消耗,水电离产生的H+、OH-的离子浓度很小,所以溶液中浓度最大的阳离子是Na+,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:

(1)上表的6种酸进行比较,酸性最弱的是:_____;HCOO-、S2-、HSO3-三种离子中,最难结合H+的是__________。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:___。
(4)下列离子方程式书写正确的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式___。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3______、NaHCO3______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的说法正确的是![]()
实验目的 | 实验方案 | |
A | 除去苯中溶有的苯酚 | 取苯与苯酚的混合液,加入浓溴水,过滤 |
B | 证明 | 将 |
C | 分离 | 将混合液倒入过滤器中过滤 |
D | 酸性: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的焓变通常用实验进行测定,也可理论推算,回答下列问题。
(1)实验测得,1 g CH3OH(l)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式_______________________________________。
(2)已知某工业生产中甲烷与水蒸汽存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) △H2
iii.CH4(g)=C(s)+2H2(g) △H3
……
Iii为积炭反应,利用△H1和△H2计算△H3时,还需要利用_____________反应的△H。(写化学方程式)
(3)氯化氢转化为氯气的催化过程如下:
CuCl2(s)=CuCl(s)+![]() Cl2(g) △H1=+83 kJ·mol-1
Cl2(g) △H1=+83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) △H2=-20 kJ·mol-1
Cl2(g) △H2=-20 kJ·mol-1
CuO(s)+2HCl(g)= CuCl2(s)+H2O(g) △H3=-121 kJ·mol-1
则4HCl(g)+ O2(g)= 2Cl2(g)+2H2O(g)的△H=___________kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由γ-羟基丁酸生成γ-丁内酯的反应如下:
![]()
γ-羟基丁酸水溶液的初始浓度为1.50 mol/L,在不同温度下测得γ-羟基丁酸的浓度随时间变化的数据如表所示。回答下列问题:
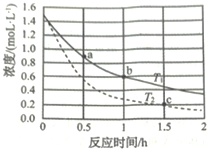
(1)温度T1________T2(大于、小于、相等、不能确定)。
(2)b点时用γ-丁内酯表示的反应速率ν(丁内酯)=_____________。
(3)c点时γ-羟基丁酸的转化率a%=__________。(保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式中,书写正确的是
A.CH4和Cl2混合后光照:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2通入Br2的CCl4溶液中:CH2=CH2+Br2→CH3CHBr2
C.CH3CH2OH在Cu作催化剂条件下与O2反应: CH3CH2OH+O2![]() CH3COOH+H2O
CH3COOH+H2O
D.CH3COOH与CH3CH2OH 发生酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
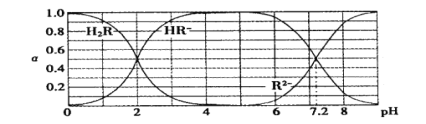
A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
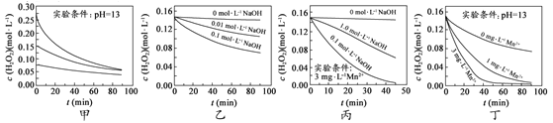
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com