
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��BaSO4��HClO��H2S |
| B��SO2��NH3��CH3COOH |
| C��H2SO4��HNO3��NaOH |
| D��NH3?H2O��H2O��H3PO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� 2-��-3-��Ȳ |
B�� 2-��-1-���� |
C�� 2-������ |
| D��CH2Cl-CH2Cl ���ȱ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶ȣ�K�� CO2ת����% n��H2��/n��CO2�� |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
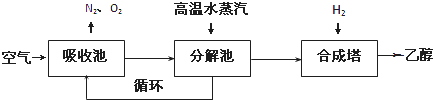
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1����pH=a��CH3COOH��Һϡ��100����������ҺpH
��1����pH=a��CH3COOH��Һϡ��100����������ҺpH�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������о���Ա������һ�ִ�����Ũ����ȩ��ˮ���·���-��Ĥ��ⷨ����ȩ�ֱ�����������������Ӧ��ת��Ϊ�Ҵ������ᣮʵ������һ��Ũ�ȵ���ȩ-Na2SO4��ҺΪ�������Һ��ģ����ȩ��ˮ�Ĵ������̣���װ����ͼ��ʾ������˵������ȷ���ǣ�������
������о���Ա������һ�ִ�����Ũ����ȩ��ˮ���·���-��Ĥ��ⷨ����ȩ�ֱ�����������������Ӧ��ת��Ϊ�Ҵ������ᣮʵ������һ��Ũ�ȵ���ȩ-Na2SO4��ҺΪ�������Һ��ģ����ȩ��ˮ�Ĵ������̣���װ����ͼ��ʾ������˵������ȷ���ǣ�������| A������CH4-����ȼ�ϵ��Ϊֱ����Դ��ȼ�ϵ�ص�a��Ӧͨ����� |
| B��������ӦCH3CHO-2e-+H2O�TCH3COOH+2H+ |
| C���������У�������Na2SO4�����ʵ������� |
| D���������У��������ֱ�����������Ҵ��⣬����������ɫ���壬��������������O2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com