
 ��1����pH=a��CH3COOH��Һϡ��100����������ҺpH
��1����pH=a��CH3COOH��Һϡ��100����������ҺpH| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������ʵ����Ԫ����ͬ����Ԫ�ص���������Ҳ��ͬ��������һ����Ϊͬ���칹�� |
| B������ʽΪCnH2n�Ļ��������ʹ����KMnO4��Һ��ɫ��Ҳ���ܲ���ɫ |
| C��ͨʽ��ͬ����������һ����n����CH2��ԭ���ŵĻ����һ����Ϊͬϵ�� |
| D�������б��������ʶ����ڷ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| O2 |
| O2 |
| H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
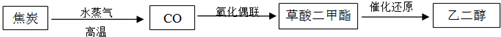
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
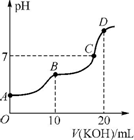
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪��ѧ��ӦN2+3H2=2NH3�������仯��ͼ��ʾ��
��֪��ѧ��ӦN2+3H2=2NH3�������仯��ͼ��ʾ��| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K+��Fe2+��SO42-��OH- |
| B��Na+��H+��Cl-��HCO3- |
| C��K+��Ag+��NO3-��Cl- |
| D��K+��Cu2+��SO42-��NO3- |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com