
| O2 |
| O2 |
| H2O |
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
| ||
| ||


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
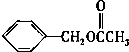 乙酸苯甲酯的结构简式如图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种( )
乙酸苯甲酯的结构简式如图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种( )| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)①pH=a的CH3COOH溶液稀释100倍后所得溶液pH
(1)①pH=a的CH3COOH溶液稀释100倍后所得溶液pH查看答案和解析>>
科目:高中化学 来源: 题型:
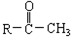 与NaOH溶液、碘水三者混合后可发生下列反应:?
与NaOH溶液、碘水三者混合后可发生下列反应:?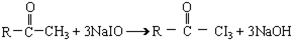 ?
?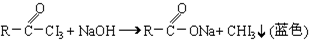
| A、HCHO |
| B、CH3CH2COCH2CH3 |
| C、CH3CHO |
| D、CH3CH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com