


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
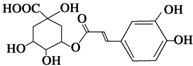 预防和治疗甲型H1N1流感的中草药中都含有金银花.绿原酸是金银花的活性成分之一,具有广泛的抗菌及抗病毒作用.有关绿原酸的说法错误的是( )
预防和治疗甲型H1N1流感的中草药中都含有金银花.绿原酸是金银花的活性成分之一,具有广泛的抗菌及抗病毒作用.有关绿原酸的说法错误的是( )| A、绿原酸的分子式为C16H18O9 |
| B、1 mol绿原酸最多可与5 mol H2发生反应 |
| C、绿原酸中含氧官能团有羧基、羟基和酯基 |
| D、绿原酸酸性条件下水解后所得两产物碳原子数之差为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知化学反应N2+3H2=2NH3的能量变化如图所示,
已知化学反应N2+3H2=2NH3的能量变化如图所示,| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时选用Fe作阳极,石墨棒作阴极 |
| B、阴极附近的沉淀只有Cr(OH)3 |
| C、阳极附近溶液中,发生反应的离子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| D、消耗1mol Cr2O72-,将有336g Fe消耗,因此要定期更换铁电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com