
 ,
, ;
; ,故答案为:
,故答案为: ;
;| 催化剂 |
| △ |
| 一定条件 |
 ,故答案为:CH≡CH+HCl
,故答案为:CH≡CH+HCl| 催化剂 |
| △ |
| 一定条件 |
 ;
;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| △ |
| △ |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
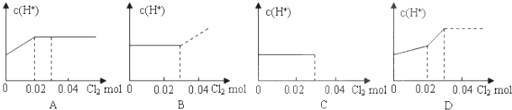
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
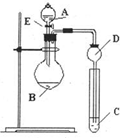 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该电池不能够在高温下工作 |
| B、电池的负极反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| C、放电过程中,H+从正极区向负极区迁移 |
| D、电池反应,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com