


科目:高中化学 来源: 题型:
| A、NaBr,NaI |
| B、NaCl,NaBr |
| C、NaCl |
| D、NaCl,I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 2.2 | 3.2 |
| Al3+ | 3.7 | 4.7 |
| Mg2+ | 9.6 | 11.1 |
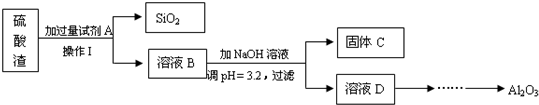
查看答案和解析>>
科目:高中化学 来源: 题型:
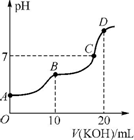
 某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.
某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:
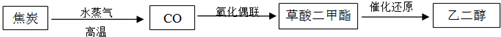
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、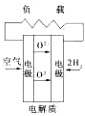 固化氧化物燃料电池 |
B、 碱性氢氧化物电池 |
C、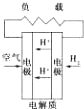 质子交换膜燃料电池 |
D、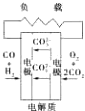 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64g O3含有的分子数目为2NA |
| B、标准状况下,22.4L H2O含有的氢原子数目为2NA |
| C、1L 1mol?L-1 CaCl2溶液中含有的氯离子数目为2NA |
| D、56g铁在足量氯气中完全燃烧转移的电子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com