
【题目】物质的量是高中化学中常用的物理量,请完成以下有关其计算的内容。
(1)0.2 g H2含有___________________个H原子。
(2)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) = _________mol/L。
(3)等质量的HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是________。
(4)当CO、CO2的分子个数之比为1:2时,原子总数之比为___________,质量之比为________;标准状况下,密度之比为__________。
【答案】0.2NA 或1.204 × 1023 3 NH3 1∶3 7∶22 7∶11
【解析】
(1)根据n=![]() ,结合1个氢气分子含有2个H原子计算解答;
,结合1个氢气分子含有2个H原子计算解答;
(2)Al2(SO4)3溶液,阳离子、阴离子的个数之比为2∶3,则二者物质的量浓度之比为2∶3;
(3)由n=![]() =
=![]() 分析解答;
分析解答;
(4)根据n=![]() =
=![]() 分析计算。
分析计算。
(1)0.2gH2含有H原子个数![]() ×2 ×NA =0.2NA,故答案为:0.2NA;
×2 ×NA =0.2NA,故答案为:0.2NA;
(2)Al2(SO4)3溶液,阳离子、阴离子的个数之比为2∶3,c(Al3+)=2.0mol/L,则其中c(SO42-)=2.0mol/L×![]() =3.0mol/L,故答案为:3.0;
=3.0mol/L,故答案为:3.0;
(3)已知:M(HCl)=36.5g/mol,M(NH3)=17g/mol,M(CO2)=44g/mol,M(O2)=32g/mol,由n=![]() =
=![]() 分析可知,相同质量时,摩尔质量越大,气体的物质的量越小,体积越小,则相同温度和相同压强条件下,体积最大的是NH3,故答案为:NH3;
分析可知,相同质量时,摩尔质量越大,气体的物质的量越小,体积越小,则相同温度和相同压强条件下,体积最大的是NH3,故答案为:NH3;
(4)由n=![]() =
=![]() 分析可知,当CO、CO2的分子个数之比为1∶2时,原子总数之比为1×2∶2×3=1∶3;质量之比为1×28∶2×44=7∶22;同温同压下,气体的密度之比等于相对分子质量之比,因此标准状况下,密度之比为28∶44=7∶11,故答案为:1∶3;7∶22;7∶11。
分析可知,当CO、CO2的分子个数之比为1∶2时,原子总数之比为1×2∶2×3=1∶3;质量之比为1×28∶2×44=7∶22;同温同压下,气体的密度之比等于相对分子质量之比,因此标准状况下,密度之比为28∶44=7∶11,故答案为:1∶3;7∶22;7∶11。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和条件被略去。A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;B、C、E是常见气体,G的焰色反应呈黄色;I的溶液呈黄色。

请回答下列问题:
(1)写出下列物质的化学式A___、F___、X___;
(2)说出黄绿色气体C的一种用途____;
(3)实验室检验H中所含的金属阳离子的方法是:___;
(4)写出Y和D溶液反应的离子方程式___;
(5)写出I与X溶液反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸[M(NOSO4H)=127g·mol-1]主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
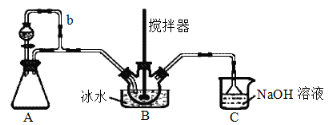
(1)装置A制取SO2,则A中反应的化学方程式为___,导管b的作用是___。
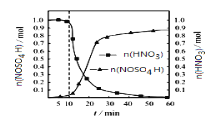
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。反应进行到10min后,反应速度明显加快,其可能的原因是___。
(3)装置C的主要作用是__。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是__。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
达到滴定终点时的现象为__,亚硝酰硫酸的纯度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.2.0gD2中含有的中子数目为0.8NA
B.4.6gC2H6O中含有C—H键的数目一定为0.6NA
C.11.2L(标准状况)由甲烷和乙烯组成的混合气体中含有氢原子数目为2NA
D.常温下,将2.8gFe置于足量的浓硝酸中,转移的电子数目—定为0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁能在二氧化碳中燃烧:2Mg+CO2![]() 2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
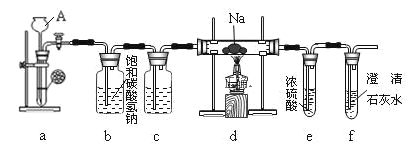
请回答下列问题:
(1)装置a中发生的是实验室制CO2的反应,反应方程式为___。
(2)装置b中发生反应的离子方程式为___,装置c的作用为___。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是___。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸, 溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化苯(基)硒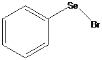 有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
(1)Br原子核外能量高的能层符号是__________,其基态原子价电子排布式为_______。
(2)C、N、O三种原子的第一电离能由大到小的顾序为_______。
(3)乙酸分子中碳原子的杂化方式为_______。
(4) H2Se的沸点_______(填“>”“<”或“=”)H2S,原因是_______。
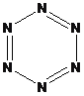
(5)晶体氮(N6)的结构如下图所示,其熔点为70℃,晶体氮中存在的作力有_______。
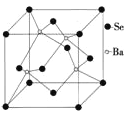
(6)BaSe可用于光电池,其晶胞结构如上图所示,晶胞参数a=0.786nm,NA代表阿伏加徳罗常数,列式计算BaSe晶胞密度为____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 ℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述不正确的是( )
A. 此时水的离子积Kw=1.0×10-12
B. 溶液中水电离出的c(H+)=1.0×10-10mol·L-1
C. 水的电离度随温度升高而增大
D. c(H+)<c(SO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com