
【题目】电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11、 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生的化学方程式为____________________。
(3)醋酸钠溶液中各离子浓度由大到小的顺序为_________________________________。
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是__________。
a.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
b.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解
c.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
d.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
(5)物质的量浓度为0.1 mol/L 的 CH3COONa 溶液和 0.1 mol/LCH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是__________。a.c(Na+)+c(H+)=c(CH3COO—)+c(OH-)
b.c(CH3COO—)+c(CH3COOH)=0.2 mol/L
c.c(CH3COOH)+2c(H+)=c(CH3COO—)+2c(OH—)
(6)若醋酸的起始浓度为1.0 mol/L,平衡时氢离子浓度c(H+)=_______。(已知: ![]() ≈1.4,计算结果保留两位有效数字)
≈1.4,计算结果保留两位有效数字)
(7)常温下,取20.00 mL氨水至锥形瓶中,用 0.05000 mol/L HCl滴定,用pH计采集数据,电脑绘制的滴定曲线如下图所示。当pH =11. 0 时,NH3H2O电离平衡常数Kb≈_______。

【答案】 b>a>d>c NaCN +CO2+H2O ═ HCN+NaHCO3 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) d ac 4.2×10-3mol·L-1 1.8×10-5
【解析】(1)由电离常数可知酸性的强弱: CH3COOH>H2CO3>HCN>NaHCO3,酸越强,对应的盐水解程度越小,则pH越小,则液的pH由大到小的顺序为b>a>d>c;(2)由电离常数可知酸性的强弱:H2CO3>HCN>NaHCO3, 25℃时,向NaCN溶液中通入少量CO2,反应生成HCN和NaHCO3,所发生的化学方程式为:NaCN +CO2+H2O ═ HCN+NaHCO3;(3)盐类的水解程度小,且醋酸钠溶液为碱性,所以离子浓度大小顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+);(4)a.稀释促进电离、促进水解,则稀释时醋酸的电离程度增大,醋酸钠的水解程度增大,选项a错误;b.电离、水解均为吸热反应,升高温度,促进水解、电离,选项b错误;d.醋酸和醋酸钠的混合液中,电离与水解相互抑制,选项d正确;c.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离,选项c错误;答案选d;(5)a.由电荷守恒①:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),选项a正确;b.由物料守恒②:c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×![]() =0.1mol/L,选项b错误;c.将②代入①即得c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),选项c正确。答案选ac;(6)c(H+)=
=0.1mol/L,选项b错误;c.将②代入①即得c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),选项c正确。答案选ac;(6)c(H+)=![]() =
=![]() =3
=3![]() ×10-3mol/L
×10-3mol/L![]() 4.2×10-3mol·L-1;(7)设氨水的物质的量浓度为c,则:c
4.2×10-3mol·L-1;(7)设氨水的物质的量浓度为c,则:c![]() 20mL=0.0500mol/L×22.40mL,解得:c=0.056mol/L,弱电解质电离平衡常数Kb=
20mL=0.0500mol/L×22.40mL,解得:c=0.056mol/L,弱电解质电离平衡常数Kb= ;pH=11的氨水中,c(OH-)=0.001mol/L, c(OH-)
;pH=11的氨水中,c(OH-)=0.001mol/L, c(OH-)![]() c(NH4+)=0.001mol/L,则:Kb=
c(NH4+)=0.001mol/L,则:Kb=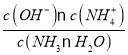 =
=![]() =1.8×10-5。
=1.8×10-5。


科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象,所得结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中含有SO |
B | 将蘸有浓氨水的玻璃棒靠近蘸有某溶液的玻璃棒 | 有白烟产生 | 该溶液是浓盐酸 |
C | 将某气体通入品红溶液中 | 溶液红色褪去 | 该气体可能是SO2 |
D | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中不含NH |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g)△H>0,达到平衡。下列说法不正确的是
CaO(s)+CO2(g)△H>0,达到平衡。下列说法不正确的是
A. 升高反应温度,压强将会增大
B. 增大压强,达新平衡时c(CO2)增大
C. 向平衡体系中加入CaO(s),平衡不移动
D. CaCO3(s)分解生成CaO(s)和CO2(g),△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于工业生产说法错误的是( )
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
B.在硫酸工业、合成氨工业中,皆采用循环操作提高原料利用率
C.在侯氏制碱工业中,二氧化碳可以循环利用
D.硫酸工业中,用水来吸收三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A. 升高温度,K增大
B. 增大压强,c(CO)不变
C. 更换高效催化剂,α(CO)增大
D. 充入一定量的氮气,n(H2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L 硫酸溶液进行中和热的测定,实验装置如图所示。

(1)已知中和热的理论值△H= -57.3kJ·mol-1,写出NaOH溶液和稀硫酸反应的中和热的热化学方程式:_______________。
(2)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
实验组 | 起始温度t1/℃ | 终止温度 t2/℃ | |
H2SO4 | NaOH | ||
1 | 26.2 | 26.0 | 30.1 |
2 | 27.0 | 27.4 | 33.1 |
3 | 26.4 | 26.2 | 30.5 |
①中和热△H=____________(取小数点后一位)。[已知:比热容c=4.18J·(g·℃)-1]
②上述实验数值结果与-57.3 kJ·mol-1有偏差,产生偏差的原因可能是______(填字母)。
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.量取NaOH溶液的体积时仰视读数
d.用温度计测定NaOH溶液起始温度后直接测量硫酸的温度
(3)若取100mL0.50mol/L NaOH溶液和50mL0.50mol/L 硫酸进行中和热的测定,其它实验条件相同,则所测得中和热的数值______(填“偏大”、“偏小”或“不变”)。
(4)已知一元弱酸HA(aq)与NaOH(aq)反应生成1mol H2O(l)时的△H= -23.1 kJ·mol-1,依据中和热的理论值,则HA(aq)![]() H+(aq)+A-(aq)的△H=____________。
H+(aq)+A-(aq)的△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的实验方法不正确的是 ( )。
A.除去Na2CO3固体中的少量NaHCO3 , 置于坩埚中加热
B.除去SO3中的少量SO2 , 可通入适量的O2
C.除去合成氨中生产的NH3中的N2、H2 , 可采用降温的方法
D.纯碱生产中所得的NH4Cl和NaHCO3混合物,可采用结晶过滤的方法分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、A13+、AlO2-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO2-、SiO32-一定存在于溶液X中 D. CO32-和SO42-一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向2L 0.5molL﹣1的KOH的溶液中加入适量的①浓硫酸、②稀醋酸、③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是( )
A.△H1<△H3<△H2
B.△H1>△H2>△H3
C.△H1>△H2=△H2
D.△H1<△H2<△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com