
【题目】分别向2L 0.5molL﹣1的KOH的溶液中加入适量的①浓硫酸、②稀醋酸、③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是( )
A.△H1<△H3<△H2
B.△H1>△H2>△H3
C.△H1>△H2=△H2
D.△H1<△H2<△H3
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11、 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生的化学方程式为____________________。
(3)醋酸钠溶液中各离子浓度由大到小的顺序为_________________________________。
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是__________。
a.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
b.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解
c.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
d.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
(5)物质的量浓度为0.1 mol/L 的 CH3COONa 溶液和 0.1 mol/LCH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是__________。a.c(Na+)+c(H+)=c(CH3COO—)+c(OH-)
b.c(CH3COO—)+c(CH3COOH)=0.2 mol/L
c.c(CH3COOH)+2c(H+)=c(CH3COO—)+2c(OH—)
(6)若醋酸的起始浓度为1.0 mol/L,平衡时氢离子浓度c(H+)=_______。(已知: ![]() ≈1.4,计算结果保留两位有效数字)
≈1.4,计算结果保留两位有效数字)
(7)常温下,取20.00 mL氨水至锥形瓶中,用 0.05000 mol/L HCl滴定,用pH计采集数据,电脑绘制的滴定曲线如下图所示。当pH =11. 0 时,NH3H2O电离平衡常数Kb≈_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Cl2通入含11g NaBr的溶液中,充分反应后将溶液蒸干,得6.55g残渣.通过计算回答
(1)NaBr是否完全反应?
(2)生成的NaCl为多少克?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.墨水、蛋白质溶液均属于胶体B.H2O、CO2均为电解质
C.NO、SO3均为酸性氧化物D.H2S、O2常作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B. 冶炼铝:铝土矿![]() NaAlO2
NaAlO2![]() 无水AlCl3
无水AlCl3![]() Al
Al
C. 制溴:浓缩海水![]() Br2
Br2![]() HBr(aq)
HBr(aq) ![]() Br2
Br2
D. 制碘:海带![]() 海带灰
海带灰![]() I2(aq)
I2(aq) ![]() I2
I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不可能作为原电池工作时发生的反应的是( )
A. Cu+2AgNO3=Cu(NO3)2+2Ag
B. 2Fe+O2+2H2O=2Fe(OH)2
C. 2H2+O2=2H2O
D. NaOH+HCl=NaCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、﹣3 | +7、﹣1 | +5、﹣3 | ﹣2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族);
(2)8个元素的最高价氧化物的水化物中,酸性最强的是(填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为 , 稳定性最强的氢化物的结构式为;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式;
(5)用电子式表示元素①与⑥形成化合物的过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断段化学反应速率最快,段收集的氢气最多. 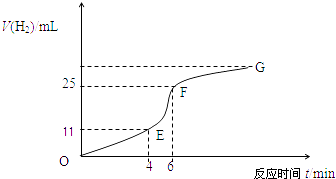
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 , 一定时间后反应速率逐渐减慢,其原因是 .
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
E.降低温度
(4)EF段产生H2的反应速率为mLmin﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com