
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B. 冶炼铝:铝土矿![]() NaAlO2
NaAlO2![]() 无水AlCl3
无水AlCl3![]() Al
Al
C. 制溴:浓缩海水![]() Br2
Br2![]() HBr(aq)
HBr(aq) ![]() Br2
Br2
D. 制碘:海带![]() 海带灰
海带灰![]() I2(aq)
I2(aq) ![]() I2
I2
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L 硫酸溶液进行中和热的测定,实验装置如图所示。

(1)已知中和热的理论值△H= -57.3kJ·mol-1,写出NaOH溶液和稀硫酸反应的中和热的热化学方程式:_______________。
(2)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
实验组 | 起始温度t1/℃ | 终止温度 t2/℃ | |
H2SO4 | NaOH | ||
1 | 26.2 | 26.0 | 30.1 |
2 | 27.0 | 27.4 | 33.1 |
3 | 26.4 | 26.2 | 30.5 |
①中和热△H=____________(取小数点后一位)。[已知:比热容c=4.18J·(g·℃)-1]
②上述实验数值结果与-57.3 kJ·mol-1有偏差,产生偏差的原因可能是______(填字母)。
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.量取NaOH溶液的体积时仰视读数
d.用温度计测定NaOH溶液起始温度后直接测量硫酸的温度
(3)若取100mL0.50mol/L NaOH溶液和50mL0.50mol/L 硫酸进行中和热的测定,其它实验条件相同,则所测得中和热的数值______(填“偏大”、“偏小”或“不变”)。
(4)已知一元弱酸HA(aq)与NaOH(aq)反应生成1mol H2O(l)时的△H= -23.1 kJ·mol-1,依据中和热的理论值,则HA(aq)![]() H+(aq)+A-(aq)的△H=____________。
H+(aq)+A-(aq)的△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
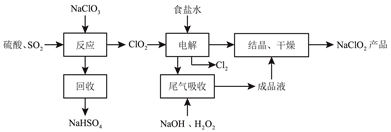
已知:亚氯酸钠在温度高于80℃时分解。下列说法不正确的是( )
A. “反应”步骤中生成ClO2的化学方程式是:2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2
B. 电解食盐水的阴极产物是NaOH和H2
C. ClO2尾气吸收时氧化剂和还原剂的物质的量之比为1:1
D. 从NaClO2溶液中得到NaClO2产品,应采用减压蒸发的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题成为人类共同关注的问题,欧洲很多国家提出了燃油车2036年停产时间表。也有专家提出燃油车远未到穷途末路,只要解决燃油汽车排放的尾气中的SO2、CO和NO污染问题就还有很长的生命,请回答以下问题:
(1)在汽车尾气管中加装催化剂成为汽车尾气治理的常用方法,已知:
①N2(g)+ O2(g)=2NO(g) △H=180.5 kJ/mol
②2CO(g)+ O2(g)=2CO2(g) △H=-566kJ/mol
写出NO(g)与CO(g)在催化剂作用下转化成N2(g)和CO2(g)的热化学方程式________________________。
(2)汽车尾气中的少量NO2也可以和CO反应生成N2(g)和CO2(g),热化学方程式为:
2NO2(g)+4CO(g)= N2(g)+4CO2(g) ,ΔH=QkJ·mol-1,试判断Q_______0(填“>”或“<”或“=”)。理由是_________________________________________
(3)除了汽车尾气产生的污染外,工业尾气及北方冬季燃煤产生SO2的污染治理也非常重要,可模仿工业上用2SO2(g )+O2(g) ![]() 2SO3(g)以制取硫酸,现在一容积固定为10L的密闭容器中进行该反应,现测得如下数据:
2SO3(g)以制取硫酸,现在一容积固定为10L的密闭容器中进行该反应,现测得如下数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
SO2 | O2 | SO2 | |||
1 | 550 | 4 | 2 | 0.4 | 9 |
2 | 650 | 2 | 1 | 0.4 | 3 |
3 | 650 | a | b | c | t |