
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn , 元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个. 根据判断出的元素回答下列问题:
(1)基态R原子核外电子排布式为 , X、Y、Z三种原子第一电离能由大到小的顺序为(用具体元素符号表示).
(2)1mol配合物[R(XY)6]4﹣中含有σ键的数目为 .
(3)XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 , 其沸点高于甲醛的主要原因是 .
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为(用文字描述).
(5)某晶体的晶胞结构如图所示,则该化合物的化学式为(R、Z用具体元素符号表示). 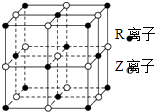
【答案】
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2;N>O>C
(2)12mol或12×6.02×1023
(3)sp2;因为COCl2的相对分子质量比甲醛大,故范德华力比甲醛大,导致其沸点比甲醛高
(4)三角锥形
(5)CoO
【解析】解:原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大,五种元素中,仅R为金属元素,其原子序数为27,则R为Co元素;X价电子排布式为nsnnpn , n=2,则X的电子排布式为2s22p2 , X为C元素;元素Z基态原子s电子总数与p电子总数相等,则Z的电子排布式只能为1s22s22p2 , 为O元素;结合Y的原子序数可知Y为N元素;W与其它四种元素能层数不同,且未成对电子数目为1个,Y只能位于第三周期,为Cl元素,(1)R的原子序数为27,其基态原子核外电子总数为27,其核外电子排布式为:1s22s22p63s23p63d74s2或[Ar]3d74s2;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能大小为:N>O>C,
所以答案是:1s22s22p63s23p63d74s2或[Ar]3d74s2;N>O>C;(2)[R(XY)6]4﹣为[Co(CN)6]4﹣ , [Co(CN)6]4﹣中CN﹣与Co之间有6个配位键,在每个CN﹣内部有一个共价键,所以1mol该配合物中含有σ键的数目为12NA(或12×6.02×1023),
所以答案是:12mol或12×6.02×1023;(3)XZW2为COCl2 , 与甲醛结构相似,则其分子中含有1个碳碳双键和2个C﹣Cl单键,其中心原子C采用sp2杂化;
由于COCl2的相对分子质量比甲醛大,则范德华力比甲醛大,导致其其沸点高于甲醛,
所以答案是:sp2;因为COCl2的相对分子质量比甲醛大,故范德华力比甲醛大,导致其沸点比甲醛高;(4)NCl3的分子中N原子形成3个N﹣Cl键,含有1对孤电子对,故其立体构型为三角锥形,
所以答案是:三角锥形;(5)R为Co、Z为O,根据均摊法可知,在这个晶胞中氧离子位于棱上和体心,数目=12× ![]() +1=4,钴离子位于顶点、面心,数目=8×
+1=4,钴离子位于顶点、面心,数目=8× ![]() +6×
+6× ![]() =4,所以氧离子、钴离子个数比是1:1,其化学式为:CoO,
=4,所以氧离子、钴离子个数比是1:1,其化学式为:CoO,
所以答案是:CoO.


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气污染是造成雾霾天气的重要原因之一,解决这个问题除了限制汽车出行外,更重要的是研发催化汽车尾气的转化技术,该技术中催化剂及载体的选择和改良是关键,某稀土催化剂催化转化汽车尾气示意图如图甲 
(1)下列有关说法正确的是 . a.C3H8与CH3CH=CH3一样,分子中碳原子都采用的是SP3杂化
b.N2、CO2、H2O都是非极性分子
c.每个CO2分子中,含有2个π键和2个σ键+
d.CO的一种等电子体为NO+ , 它的电子式为 ![]()
(2)CO与Fe可生成羰基铁[Fe(CO)5],已知其中铁为0价,铁原子的基态核外电子排布式为 , [Fe(CO)5],中配位原子是 , 理由是 .
(3)C、N、O三种元素的第一电离能由大到小的顺序是 , Al2O3晶体熔点高是耐火材料,AlCl3晶体易升华,熔点低,工业上电冶制取铝用前者而不用后者的原因是 .
(4)钙钛矿型符合氧化物也可作为汽车尾气转化的催化剂,一种复合氧化物晶胞结构如图乙所示,则与每个Sr2+与个O2﹣紧邻,若Sr2+与紧邻O2﹣的核间距为apm,阿伏加德罗常数为NA , 则该氧化物晶体密度的计算表达式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图甲所示为二维平面晶体示意图,化学式表示为AX3的是________。
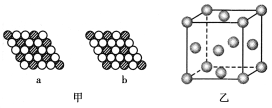
(2)图乙为一个金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________个;
②该晶胞称为________(填序号);
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数为________(用aρ表示)。
(3)《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如下图所示。下列有关说法正确的是________。
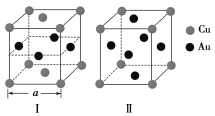
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的边长为a cm,则图Ⅰ中合金的密度为![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素周期表中短周期主族非金属元素的一部分,下列说法不正确的是( )
X | Y |
Z | W |
A.W的原子序数可能是Y的两倍
B.Z的原子半径比Y的大
C.Y元素的非金属性比X元素的强
D.Z、W的氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【实验化学】 偶氮苯是橙红色晶体,溶于乙醇,微溶于水,广泛应用于染料制造和橡胶工业,以硝基苯、镁粉和甲醇为原料制造偶氮苯的实验步骤如下:
步骤一:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管:加入少量镁粉,立即发生反应.
步骤二:等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30min.
步骤三:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤.
步骤四:用95%的乙醇重结晶.
(1)步骤一中反应不需要加热就能剧烈进行,原因是 . 镁粉分两次加入而不是一次性全部加入的原因是 .
(2)步骤三中析出固体用冰水洗涤的原因是 . 若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管(应接管)和锥形瓶外还应有 .
(3)取0.1g偶氮苯,溶于5mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射.用毛细管各取上述两试管中的溶液点在距离滤纸条末端1cm处,再将滤纸条末端浸入装有1:3的苯环己烷溶液的容器中,实验操作及现象如图所示. ①实验中分离物质所采用的方法是法.
②由实验结果可知:;利用该方法可以提纯反式偶氮苯.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向H2O中通人 NO2:3NO2+H2O═H++NO3﹣+2NO
B.向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32﹣
C.用饱和纯減溶液洗涤试管中残留的苯酚:CO32﹣+2 ![]() →2
→2 ![]() +CO2↑+H2O
+CO2↑+H2O
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.
(1)F+离子的电子排布式是 .
(2)B、C、D元素的第一电离能由大到小的顺序是 .
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是 .
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是 .
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 , C原子的配位数是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属冶炼的说法中,不正确的是
A.金属冶炼的实质是金属阳离子被还原成单质
B.用碳粉或铝粉还原铁矿石可以获取金属Fe
C.通过电解NaCl溶液的方法可以获取金属Na
D.冶炼铜的常用方法有火法炼铜和湿法炼铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com