
【题目】下列指定反应的离子方程式正确的是( )
A.向H2O中通人 NO2:3NO2+H2O═H++NO3﹣+2NO
B.向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32﹣
C.用饱和纯減溶液洗涤试管中残留的苯酚:CO32﹣+2 ![]() →2
→2 ![]() +CO2↑+H2O
+CO2↑+H2O
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Fe(OH)3↓
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO3)2并对其性质进行探究. 【背景素材】
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO3)2+H2O
Ⅱ.Ca(NO3)2能被酸性KmnO4溶液氧化成NO3﹣ , MnO4﹣被还原为Mn2+
Ⅲ.在酸性条件下,Ca(NO3)2能将I﹣氧化为I2 , S2O32﹣能将I2还原为I﹣
【制备氮氧化物】
(1)甲组同学拟利用如图所示装置制备氮氧化物. 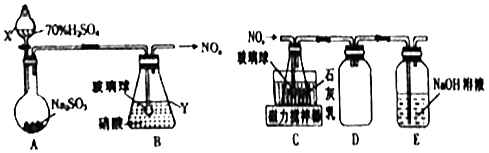
①仪器X、Y的名称分别是、 .
②装置B中逸出的NO与NO2的物质的量之比为1:1,则装置B中发生反应的化学方程式为 .
(2)【制备Ca(NO2)2】 乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2 , 装置如上右图.
①装置C中导管末端接一玻璃球的作用是 .
②装置D的作用是;装置E的作用是 .
(3)【测定Ca(NO2)2的纯度】 丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1molL﹣1的KI溶液 c.淀粉溶液 d.c2molL﹣1的Na2S2O3溶液e.c3molL﹣1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定起其纯度,可选择的试剂是(填字母).
②利用Ca(NO2)2的氧化性来测定起纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,(请补充完整实验步骤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn , 元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个. 根据判断出的元素回答下列问题:
(1)基态R原子核外电子排布式为 , X、Y、Z三种原子第一电离能由大到小的顺序为(用具体元素符号表示).
(2)1mol配合物[R(XY)6]4﹣中含有σ键的数目为 .
(3)XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 , 其沸点高于甲醛的主要原因是 .
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为(用文字描述).
(5)某晶体的晶胞结构如图所示,则该化合物的化学式为(R、Z用具体元素符号表示). 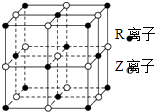
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题: (一)碳酸钙的制备
(1)步骤①加入氨水的目的是 . 小火煮沸的作用是使沉淀颗粒长大,有利于 .
(2)如图是某学生的过滤操作示意图,其操作不规范的是(填标号). 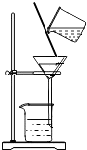
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加过过滤速度
(3)(二)过氧化钙的制备 ![]()
步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈性(填“酸”、“碱”或“中”).将溶液煮沸,趁热过滤,将溶液煮沸的作用是 .
(4)步骤③中反应的化学方程式为 , 该反应需要在冰浴下进行,原因是 .
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是 .
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是 , 产品的缺点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
A.0.1 mol?L﹣1 HC1 ![]() ?C12
?C12 ![]() ?Ca(ClO)2(aq)
?Ca(ClO)2(aq)
B.Al3+ ![]() ?A1O2﹣
?A1O2﹣ ![]() ?Al(OH)3
?Al(OH)3
C.A1 ![]() ?NaA1O2(aq)
?NaA1O2(aq) ![]() ?NaAlO2(s)
?NaAlO2(s)
D.MgO(s) ![]() ?Mg(NO3)2(aq)
?Mg(NO3)2(aq) ![]() ?Mg(s)
?Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.当X是强酸时,C在常温下是气态单质
D.B和Cl2的反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性.
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 |
(1)对实验Ⅰ进行研究②④ ①实验Ⅰ中生成红色物质的离子方程式为:
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:
③请写出60s后反应进一步加快可能的原因(写出两条)
(2)对实验Ⅱ进行研究 实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
实验Ⅵ的设计目的是:
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:
(4)请设计实验证明Cl﹣对Al与H+的反应同样起到相似的作用:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com