
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性.
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 |
(1)对实验Ⅰ进行研究②④ ①实验Ⅰ中生成红色物质的离子方程式为:
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:
③请写出60s后反应进一步加快可能的原因(写出两条)
(2)对实验Ⅱ进行研究 实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
实验Ⅵ的设计目的是:
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:
(4)请设计实验证明Cl﹣对Al与H+的反应同样起到相似的作用:
【答案】
(1)2Al+3Cu2+=2Al3++3Cu;Cu2++2H2O?Cu(OH)2+2H+;Cu和Al在酸性条件下形成原电池;反应放热,温度升高速率加快
(2)Cl﹣对Al与Cu2+的置换反应存在促进作用
(3)0.02mol;对照实验,排除Na+的干扰,证明Na+对该反应不造成影响;SO42﹣对Al与Cu2+的置换反应没有抑制作用;Cl﹣对Al与Cu2+的置换反应存在促进作用
(4)用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈
【解析】解:(1)①实验Ⅰ:0.5mol/LCuCl2溶液,大量气泡且有红色物质析出是铝置换铜生成的铜单质,反应的离子方程式为:2Al+3Cu2+=2Al3++3Cu, 所以答案是:2Al+3Cu2+=2Al3++3Cu;②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因是铜离子水解的结果,Cu2++2H2OCu(OH)2+2H+ ,
所以答案是:Cu2++2H2OCu(OH)2+2H+;③60s:反应进一步加快且反应剧烈放热,液体几乎沸腾,说明反应是放热反应,温度升高速率加快,置换出的铜和铝在电解质溶液中析出原电池反应加快反应速率,
所以答案是:Cu和Al在酸性条件下形成原电池;反应放热,温度升高速率加快;(2)实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,实验Ⅰ:0.5mol/LCuCl2溶液,实验Ⅱ:0.5mol/LCuSO4溶液和铝反应氯离子和硫酸根离子对反应影响,假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用,假设二:Cl﹣对Al与Cu2+的置换反应存在促进作用,
所以答案是:Cl﹣对Al与Cu2+的置换反应存在促进作用;(3)探究假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用,假设二:Cl﹣对Al与Cu2+的置换反应存在促进作用,对比实验需要加入氯化铵和氯化钠物质的量相同,实验Ⅵ:0.5mol/LCuSO4溶液加入0.02molNH4Cl固体,未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全,设计目的是对照实验,排除Na+的干扰,证明Na+对该反应不造成影响,其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:SO42﹣对Al与Cu2+的置换反应没有抑制作用,其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:Cl﹣对Al与Cu2+的置换反应存在促进作用,
所以答案是:0.02mol; 对照实验,排除Na+的干扰,证明Na+对该反应不造成影响;SO42﹣对Al与Cu2+的置换反应没有抑制作用;Cl﹣对Al与Cu2+的置换反应存在促进作用;(4)请设计实验证明Cl﹣对Al与H+的反应同样起到相似的作用,可以利用氢离子浓度相同的硫酸和盐酸,用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈,
所以答案是:用砂纸打磨后的铝片分别与H+浓度均为0.2mol/L的盐酸和硫酸反应,前者更剧烈.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向H2O中通人 NO2:3NO2+H2O═H++NO3﹣+2NO
B.向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32﹣
C.用饱和纯減溶液洗涤试管中残留的苯酚:CO32﹣+2 ![]() →2
→2 ![]() +CO2↑+H2O
+CO2↑+H2O
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属冶炼的说法中,不正确的是
A.金属冶炼的实质是金属阳离子被还原成单质
B.用碳粉或铝粉还原铁矿石可以获取金属Fe
C.通过电解NaCl溶液的方法可以获取金属Na
D.冶炼铜的常用方法有火法炼铜和湿法炼铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于海水资源综合利用的说法中,正确的是
A.可用海水晒盐的方法提取海水中的淡水资源
B.只通过物理变化即可提取海水中的溴单质
C.从海带灰中提取I-,需加入CCl4萃取
D.利用海水、铝、空气发电是将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( ) 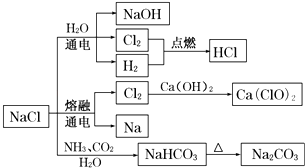
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.NaHCO3 受热分解的方程式为:2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.电解饱和氯化钠溶液的方程式为:2NaCl ![]() 2Na+Cl2↑
2Na+Cl2↑
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(X代表卤素原子,R代表烃基) 
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B_、D
(2)反应①~⑦中属于消去反应的是(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(X代表卤素原子,R代表烃基) 
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)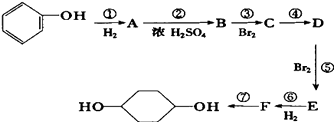
请回答下列问题:
(1)分别写出B、D的结构简式:B_、D
(2)反应①~⑦中属于消去反应的是(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com