
【题目】下列关于海水资源综合利用的说法中,正确的是
A.可用海水晒盐的方法提取海水中的淡水资源
B.只通过物理变化即可提取海水中的溴单质
C.从海带灰中提取I-,需加入CCl4萃取
D.利用海水、铝、空气发电是将化学能转化为电能
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题: (一)碳酸钙的制备
(1)步骤①加入氨水的目的是 . 小火煮沸的作用是使沉淀颗粒长大,有利于 .
(2)如图是某学生的过滤操作示意图,其操作不规范的是(填标号). 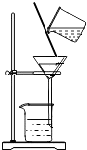
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加过过滤速度
(3)(二)过氧化钙的制备 ![]()
步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈性(填“酸”、“碱”或“中”).将溶液煮沸,趁热过滤,将溶液煮沸的作用是 .
(4)步骤③中反应的化学方程式为 , 该反应需要在冰浴下进行,原因是 .
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是 .
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是 , 产品的缺点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.液氯和氯气是同种物质
B.金刚石和石墨互为同素异形体,两者之间不能相互转化
C.CH3CH2OH和CH3OCH3互为同分异构体
D.H、D、T互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.酿酒过程中,葡萄糖可通过水解反应生成酒精
B.丙烷和2﹣甲基丙烷的一氯代物均为两种
C.油脂发生皂化反应能生成甘油
D.![]() 是高分子化合物
是高分子化合物 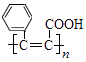 的单体
的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配位键是一种特殊的共价键,即共用电子对由某原子单方面提供,同时和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是 (填字母)。
A.CO2 B.H3O+ C.CH4 D.H2SO4
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式: 。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲: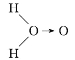 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓硫酸反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中的化学反应方程式为(A写结构简式) 。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性.
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 |
(1)对实验Ⅰ进行研究②④ ①实验Ⅰ中生成红色物质的离子方程式为:
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:
③请写出60s后反应进一步加快可能的原因(写出两条)
(2)对实验Ⅱ进行研究 实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
实验Ⅵ的设计目的是:
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:
(4)请设计实验证明Cl﹣对Al与H+的反应同样起到相似的作用:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ gmL﹣1 , 溶质的质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A.溶质的质量分数w= ![]() ×100%
×100%
B.溶质的物质的量浓度c= ![]() ?mol?L﹣1
?mol?L﹣1
C.溶液中c(OH﹣)= ![]() ?mol?L﹣1+c(H+)
?mol?L﹣1+c(H+)
D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对电解质的叙述正确的是( )
A. 溶于水后得到的溶液能导电的物质
B. 氯化氢溶于水能导电,但液态氯化氢不能导电
C. NaCl是电解质故NaCl晶体能导电
D. NaCl溶液在电流作用下电离成Na+和Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com