
【题目】汽车尾气污染是造成雾霾天气的重要原因之一,解决这个问题除了限制汽车出行外,更重要的是研发催化汽车尾气的转化技术,该技术中催化剂及载体的选择和改良是关键,某稀土催化剂催化转化汽车尾气示意图如图甲 
(1)下列有关说法正确的是 . a.C3H8与CH3CH=CH3一样,分子中碳原子都采用的是SP3杂化
b.N2、CO2、H2O都是非极性分子
c.每个CO2分子中,含有2个π键和2个σ键+
d.CO的一种等电子体为NO+ , 它的电子式为 ![]()
(2)CO与Fe可生成羰基铁[Fe(CO)5],已知其中铁为0价,铁原子的基态核外电子排布式为 , [Fe(CO)5],中配位原子是 , 理由是 .
(3)C、N、O三种元素的第一电离能由大到小的顺序是 , Al2O3晶体熔点高是耐火材料,AlCl3晶体易升华,熔点低,工业上电冶制取铝用前者而不用后者的原因是 .
(4)钙钛矿型符合氧化物也可作为汽车尾气转化的催化剂,一种复合氧化物晶胞结构如图乙所示,则与每个Sr2+与个O2﹣紧邻,若Sr2+与紧邻O2﹣的核间距为apm,阿伏加德罗常数为NA , 则该氧化物晶体密度的计算表达式为 .
【答案】
(1)bd
(2)[Ar]3d64s2或者1s22s22p63s23p63d64s2;C;配体中C的电负性小于O,C原子核提供孤店子对配位能力强于O原子
(3)N>O>C;AlCl3晶体易升华,熔点低,是分子晶体,熔融时不导电,无法电解
(4)12;![]()
【解析】解:(1)a.C3H8分子中每个C含有4个σ键,且每个C原子价层电子对个数是4,则C原子采用sp3杂化;CH3CH=CH3分子中存在C﹣C单和C=C原子,且每个C原子价层电子对个数是4,则C原子采用sp3和sp2杂化,故a错误; b.N2是以非极性键结合的双原子一定为非极性分子,CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,H2O的立体构型为v型,结构对称,分子重心重叠,为非极性分子,故b正确;
c.CO2的结构式为O=C=O,中含有2个π键,2个σ键,故c错误;
d.CO的一种等电子体为NO+ , CO的结构为C≡O,则NO+的电子式为![]() , 故d正确;
, 故d正确;
所以答案是:bd;(2)Fe的原子序数为26,根据能量最低原理和洪特规则可写出基态Fe原子核外电子排布式为1s22s22p63s23p63d64s2或者[Ar]3d64s2 , [Fe(CO)5]中心原子是Fe,CO提供孤电子对为配体,配位原子是为C,理由是配体中C的电负性小于O,C原子核提供孤店子对配位能力强于O原子,
所以答案是:1s22s22p63s23p63d84s2或者[Ar]3d64s2;C;配体中C的电负性小于O,C原子核提供孤店子对配位能力强于O原子;(3)根据第一电离能的定义判断,指基态的气体原子失去一个电子形成+1价气态阳离子时所需的能量,即N>O>C;根据物质性质及晶体类型选择冶制金属的方法,因为AlCl3晶体易升华,熔点低,是分子晶体,熔融时不导电,无法电解所以电解Al2O3来制备金属铝,
所以答案是:N>O>C;AlCl3晶体易升华,熔点低,是分子晶体,熔融时不导电,无法电解;(4)Sr2+在晶胞的体心,与之紧邻的O2﹣在晶胞的棱上,12条棱,每个Sr2+紧邻的O2﹣有12;由晶胞结构得N(sr2+)=1,N(O2﹣)=12× ![]() =3,N(Ti4+)=8×
=3,N(Ti4+)=8× ![]() =1 所以晶胞的分子式为SrOTiO2则M=88+16+48+16×2=184g/mol,Z=1,∵Sr2+与紧邻O2﹣的核间距为apm,设晶胞的变成为x,则(2a)2=x2+x2解得x=
=1 所以晶胞的分子式为SrOTiO2则M=88+16+48+16×2=184g/mol,Z=1,∵Sr2+与紧邻O2﹣的核间距为apm,设晶胞的变成为x,则(2a)2=x2+x2解得x= ![]() a∴V=(
a∴V=( ![]() a×10﹣10)cm3 根据公式D=
a×10﹣10)cm3 根据公式D= ![]() =
= ![]() ,
,
所以答案是:12; ![]() .
.


科目:高中化学 来源: 题型:
【题目】一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(l)+3O2(g)﹦XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。
(1)反应前O2的体积是________mL(标准状况下)。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别是________和________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。请回答下列问题:
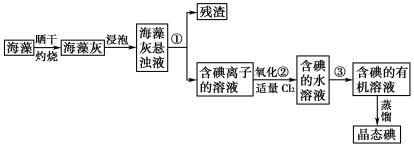
(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为紫红色溶液)。

(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①________________________________;
②________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的![]() 、
、![]() 和Cl。
和Cl。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在![]() 。
。
③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl。其中,加入足量Ba(NO3)2溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO3)2并对其性质进行探究. 【背景素材】
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO3)2+H2O
Ⅱ.Ca(NO3)2能被酸性KmnO4溶液氧化成NO3﹣ , MnO4﹣被还原为Mn2+
Ⅲ.在酸性条件下,Ca(NO3)2能将I﹣氧化为I2 , S2O32﹣能将I2还原为I﹣
【制备氮氧化物】
(1)甲组同学拟利用如图所示装置制备氮氧化物. 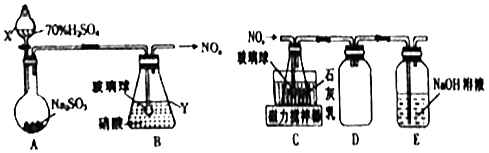
①仪器X、Y的名称分别是、 .
②装置B中逸出的NO与NO2的物质的量之比为1:1,则装置B中发生反应的化学方程式为 .
(2)【制备Ca(NO2)2】 乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2 , 装置如上右图.
①装置C中导管末端接一玻璃球的作用是 .
②装置D的作用是;装置E的作用是 .
(3)【测定Ca(NO2)2的纯度】 丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1molL﹣1的KI溶液 c.淀粉溶液 d.c2molL﹣1的Na2S2O3溶液e.c3molL﹣1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定起其纯度,可选择的试剂是(填字母).
②利用Ca(NO2)2的氧化性来测定起纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,(请补充完整实验步骤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法不正确的是 ( )

A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③12,④12
D.空间利用率的大小关系为:①<②<③=④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn , 元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个. 根据判断出的元素回答下列问题:
(1)基态R原子核外电子排布式为 , X、Y、Z三种原子第一电离能由大到小的顺序为(用具体元素符号表示).
(2)1mol配合物[R(XY)6]4﹣中含有σ键的数目为 .
(3)XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 , 其沸点高于甲醛的主要原因是 .
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为(用文字描述).
(5)某晶体的晶胞结构如图所示,则该化合物的化学式为(R、Z用具体元素符号表示). 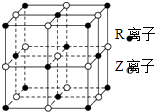
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com