
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的有关说法中正确的是 ( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+ 与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取1.500 g样品,加水溶解,配成250 mL溶液。
步骤Ⅱ 用酸式滴定管量取25.00 mL样品溶液于250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据实验步骤填空:
①步骤Ⅰ中用到的主要玻璃仪器有 ;
②步骤Ⅱ中酸式滴定管用蒸馏水洗涤后,直接加入样品溶液进行量取,则测得样品中氮质量分数 (填“偏高”、“偏低”或 “无影响”,下同)。锥形瓶用蒸馏水洗涤后,水未倒尽,则对滴定时用去NaOH标准溶液的体积 。滴定时对NaOH标准溶液体积,读取初读数时仰视,读取终读数时姿势正确,则测得样品中氮质量分数 。
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如表所示:
| 滴定次数 | 待测溶液体积/ml | 标准NaOH溶液体积读数(ml) | |
| 滴定前/ml | 滴定后/ml | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.30 | 22.30 |
则消耗NaOH标准溶液的体积平均为 mL,该样品中氮的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业[b16] 上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
 |
(1)向滤液中通入过量CO2所发生反应的离子方程式为 ▲ 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 ▲ 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有___▲___。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在____▲____。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为____▲_________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是____▲_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于①乙烯②苯③乙醇④乙酸⑤葡萄糖等有机物的叙述不正确的是
A.可以用新制的Cu(OH)2悬浊液鉴别③④⑤ B只有②(3④能发生取代反应
C只有①③⑤能使酸性KMnO4溶液褪色 D.一定条件下,⑤可以转化为③
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原子序数小于36的X、 Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素, Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为_________,1molY2X2含有 键的数目为____ __________________.
键的数目为____ __________________.
②化合物ZX3的沸点比化台物YX4的高,其主要原因是_____________。
 ③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
(2)铁元素能形成多种配合物,如:Fe(CO)x
①基态Fe3+的M层电子排布式为___________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为
18.则x=_________。常温下呈液态,熔点为-20.5℃,沸
点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(填晶体类型):
(3)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_________。已知该晶胞的密度为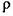 g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含 的计算式表示)
的计算式表示)
(4)下列有关的说法正确的是_____________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为品格能Ca0比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率如下,其中化学反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率如下,其中化学反应速率最快的是( )
A.v(D)=0.4 mol/(L•s) B. v(C)=0.5 mol/(L•s)
C. v(B)=0.6 mol/(L•s) D. v(A)=0.15 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸
中一段时间,下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙大

查看答案和解析>>
科目:高中化学 来源: 题型:
金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是
( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Cu都是用热还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com