
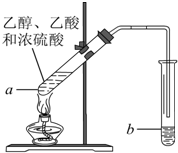
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.分析 (1)乙醇含有官能团为羟基;
(2)加入碎瓷片或沸石,可防止液体飞溅;
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯;
(5)分离互不相溶的液体,可以分液的方法分离;
(6)有机酯化反应的实质是酸脱羟基醇脱氢.
解答 解:(1)乙醇含有官能团为羟基,
故答案为:羟基;
(2)为防止液体飞溅,应加入碎瓷片或沸石,
故答案为:防止液体暴沸;
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,反应的化学方程式为CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O,反应类型为取代反应,
故答案为:CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O;取代反应;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,
故答案为:饱和Na2CO3溶液;
(5)因为乙酸乙酯难溶于饱和碳酸钠,则b中的液体混合物分层,可用分液漏斗分离,该方法叫分液,故答案为:分液;
(6)将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应,化学方程式为:CH3COOH+H18OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O;
A、生成的乙酸乙酯中含有18O,故A正确;
B、生成的水分子中不含有18O,故B错误;
C、乙酸乙酯的摩尔质量为88g/mol,1mol乙醇应反应生成1mol乙酸乙酯,但反应是可逆反应,乙酸和乙醇挥发,所以不能进行彻底,应小于90g,可能生成44g乙酸乙酯,故C正确;
D、乙酸乙酯的摩尔质量为88g/mol,1mol乙醇应反应生成1mol乙酸乙酯,但反应不能进行彻底,所以应小于90g,故D正确;
故答案为:B.
点评 本题考查乙酸乙酯的制备,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,注意基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 | |
| B. | 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g);△H<0,则该反应一定能自发进行 | |
| D. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | 盐酸与NaOH溶液反应的中和热△H=-57.3kJ•mol-1,则硫酸和Ca(OH)2溶液反应的中和热△H=-2×57.3kJ•mol-1 | |
| D. | 一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,则有N2(g)+3H2(g)?2NH3(g)△H=-80kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
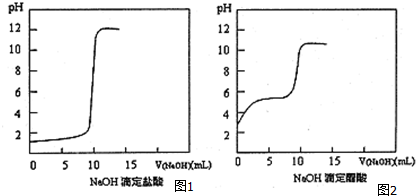
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
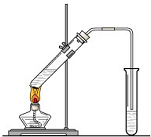 实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:
实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
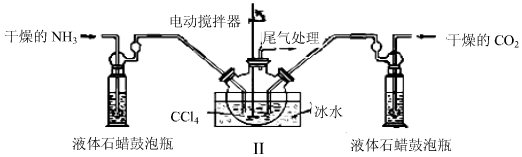
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com