
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | 盐酸与NaOH溶液反应的中和热△H=-57.3kJ•mol-1,则硫酸和Ca(OH)2溶液反应的中和热△H=-2×57.3kJ•mol-1 | |
| D. | 一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,则有N2(g)+3H2(g)?2NH3(g)△H=-80kJ•mol-1 |
分析 A.等质量的硫蒸气具有的能量比硫固体多;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热;
C.根据中和热的概念可知,中和热为△H=-57.3kJ/mol,且生成硫酸钙沉淀放热;
D.一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,反应为可逆反应不能进行彻底.
解答 解:A.等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故A正确;
B.1molH2在足量氯气中完全燃烧所放出的热量,不是H2的燃烧热,故B错误;
C.中和热是在稀溶液中强酸与强碱反应生成1mol水放出的热量,中和热为-57.3KJ/mol,H2SO4和Ca(OH)2反应生成硫酸钙沉淀也放热,则H2SO4和Ca(OH)2反应的中和热小于-57.3kJ/mol,故C错误;
D.一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,反应为可逆反应不能进行彻底,反应焓变是指1molN2和3molH2完全反应生成2molNH3时放出的热量,则有N2(g)+3H2(g)?2NH3(g)△H<-80kJ•mol-1,故D错误;
故选A.
点评 本题考查了化学反应能量变化、反应焓变和反应热的比较判断、燃烧热、中和热概念的理解应用,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=3 mol•L-1•min-1 | B. | v(B)=6 mol•L-1•min-1 | ||
| C. | v(C)=2.5 mol•L-1•min-1 | D. | v(D)=4 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
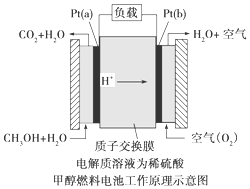
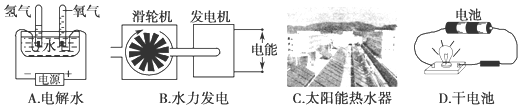
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶解后未经冷却,迅速转移到容量瓶中 | |
| B. | 容量瓶未干燥 | |
| C. | 定容时俯视液面 | |
| D. | 洗涤烧杯和玻璃棒的溶液未转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 1.8 mol/(L•min) | C. | 0.6mol/(L•min) | D. | 2.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小反应物浓度,可减小单位体积内活化分子的百分数,从而使有效碰撞次数减少 | |
| B. | 对于有气体参加的化学反应,若减小压强(即扩大反应容器的体积),可减小活化分子的百分数,从而使反应速率减小 | |
| C. | 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率 | |
| D. | 能量高的分子一定能发生有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉的最简式:CH2O | B. | 邻羟基苯甲酸的结构简式: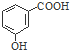 | ||
| C. | 2-乙基-1,3-丁二烯的键线式: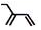 | D. | 苯分子球棍模型: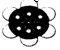 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
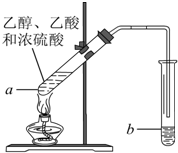 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com