
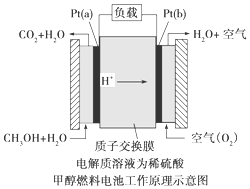
分析 (1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应;
(2)根据甲醇和转移电子之间的关系式计算;
(3)原电池将化学能转化为电能.
解答 解:(1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,则Pt(a)为负极,负极上失电子发生氧化反应,电极方程式为CH3OH+H2O-6e-═CO2+6H+,
故答案为:CH3OH+H2O-6e-═CO2+6H+;
(2)由电极方程式CH3OH+H2O-6e-═CO2+6H+可知,如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有$\frac{1}{3}$mol,
故答案为:$\frac{1}{3}$;
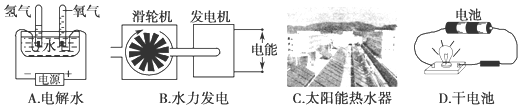
(3)A.是电解装置,将电能转化成化学能,故A错误;
B.机械能转化为电能,故B错误;
C.太阳能转化成热能,故C错误;
D.干电池属于原电池,将化学能转化成电能,故D正确;
故答案为:D.
点评 本题考查了原电池的工作原理,根据离子交换膜通过的微粒确定电解质溶液的酸碱性,再结合正负极上发生的反应来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1,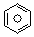 (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 | |
| B. | 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g);△H<0,则该反应一定能自发进行 | |
| D. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | 盐酸与NaOH溶液反应的中和热△H=-57.3kJ•mol-1,则硫酸和Ca(OH)2溶液反应的中和热△H=-2×57.3kJ•mol-1 | |
| D. | 一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,则有N2(g)+3H2(g)?2NH3(g)△H=-80kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
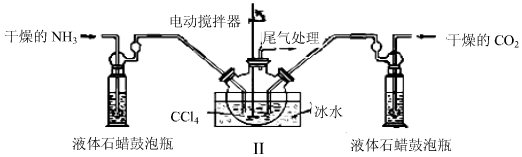
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com