
【题目】氢气是重要的化工原料。
(1)利用H2S制备H2.已如:在较低温度下发生下列反应:
①H2S(g)+H2SO4(aq)═S(s)+SO2(g)+2H2O(1) △H1=+61kJmol-1
②SO2(g)+I2(s)+2H2O(1)═2HI(aq)+H2SO4(aq) △H2=-151kJmol-1
③2HI(aq)H2(g)+I2(s) △H3=+110kJmol-1
④H2S(g) H2(g)+S(s) △H4=__kJmol-1。
(2)乙烯是合成食品外包装材料一聚乙烯的单体。工业上利用H2和CO2可以制备乙烯,2CO2(g)+6H2(l)C2H4(g)+4H2O(g) △H
①在2L恒容密闭容器中投入4molCO2和amolH2,在某催化剂作用下发生上述反应,CO2的转化率与温度关系如图1所示。
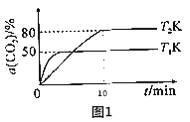
由图1判断,T2__T1(填“>”、“<”或“=”);T2K下,0~10min内H2的平均反应速率v(H2)=__molL-1min-1。
②测得单位时间内C2H4产率与温度、投料比![]() 关系如图2所示。
关系如图2所示。
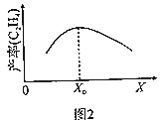
若X为温度,当温度高于X0时,单位时间内乙烯产率降低的原因可能是__。
若X为投料比,当![]() 大于X0时,乙烯产率降低的原因可能是__。
大于X0时,乙烯产率降低的原因可能是__。
③在某温度下达到平衡后,在t0时只改变一个外界条件,反应速率(v)与时间(t)的关系如图3所示。改变的条件可能是___(填字母)。

A.增大反应物浓度
B.增大压强
C.升高温度
D.加入高效催化剂
(3)科学家已研究出生物酶,利用原电池原理在常温和生物酶作用下N2和H2合成NH3,即H2在负极上发生氧化反应,H+通过质子交换膜迁移到正极区,正极上合成NH3。正极的电极反应式为__。
【答案】+20 < 0.48 B 催化剂活性降低 H2和C2H4发生加成反应 N2+6e-+6H+=2NH3
【解析】
(1)根据盖斯定律计算;
(2)①根据“先拐先平数值大”判断,根据图像知道T2下CO2的转化率,利用二氧化碳和氢气的计量数之比,计算出v(H2)=![]() ;
;
②若X代表温度,考虑催化剂的活性,若X代表投料比,考虑氢气与乙烯发生反应;
③图像上可以得到正反应速率大于逆反应速率,是突然增大的因素,不是浓度的影响;
(3)H+向正极移动,正极上是氮气得电子生成氨气,写出电极反应式;
(1)根据盖斯定律,①+②+③=④,可得ΔH4=+20kJ/mol;
(2)由图①可知,T1先达到平衡,说明温度较高,即T1>T2。由平衡转化率可知,温度越低,CO2的平衡转化率较高,说明正反应是放热反应。根据氢气的二氧化碳的计量数之比可知,氢气的速率是二氧化碳速率的三倍,故v(H2)=![]() =
=![]() =0.48mol/L;
=0.48mol/L;
由图②可知,高于X0时,产率降低,单位时间内产率实际反映速率大小,若X代表温度,可能是温度过高,催化剂失去活性;若X代表投料比,投料比高于X0,可能是H2和乙烯发生加成反应。
③改变条件,正逆反应速率都增大,(速率离开原平衡),平衡向正反应速率移动。
A.增大反应物浓度,正反应速率增大,逆反应速率不变,随后逆反应速率增大,正反应速率减小,改变条件瞬时,逆反应速率与原平衡点连接(不离开原平衡),与图像不符,故A错误;
B.增大压强,正逆反应速率都增大,正反应的计量数大于逆反应,平衡向正方向移动;
C.该可逆反应的正反应是放热反应,升高温度,平衡向逆反应方向移动,即升高温度,正逆反应速率都增大,逆反应方向速率增大程度大于正反应,与图像不符;
D.加入高效催化剂,只能缩短达到平衡的时间,平衡不移动,与图像不符;
答案选B。
(3)依题意,负极区H+向正极区迁移,正极反应式为N2+6e-+6H+=2NH3。


科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
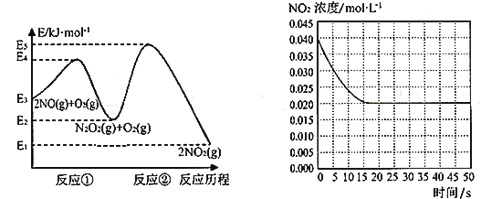
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______;该温度下反应2NO+O2![]() 2NO2的化学平衡常数K为_____。
2NO2的化学平衡常数K为_____。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____(填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________。
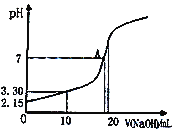
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。
回答下列问题:
(1)b、c、d中第一电离能最大的是____________(填元素符号),e的价层电子排布图为_________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_________;分子中既含有极性共价键、又含有非极性共价键的化合物是__________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_________(任写一种);酸根呈三角锥结构的酸是___________(填化学式)。
(4)e和c形成的一种离子化合物的晶体结构如图1所示,则e离子的电荷为__________。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中,阴离子为__________,阳离子中存在的化学键类型有____________;该化合物加热时首先失去的组分是____________,判断理由是___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏伽德罗常数的值。下列说法错误的是( )
A.常温常压下,40gSO3含原子总数为2NA
B.1mol铜锌合金与足量稀硝酸反应转移电子数为2NA
C.1L1molL-1CH3COONH4中性溶液含NH4+数目为NA
D.1mol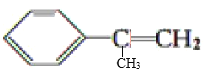 分子中最多共平面的碳原子数为9NA
分子中最多共平面的碳原子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如右下图(二茂铁熔点是173℃,在100℃时开始开华;沸点是249℃)。实验步骤为:
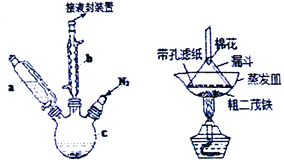
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(密度0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入仪器d,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是______________,作用是________________________。
(2)步骤①中通入氮气的目的是__________________________________。
(3)仪器c的适宜容积应为_________:①100mL、②250mL、③500mL;仪器a使用前应进行的操作是_______________________________________。
(4)KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl的化学方程式为_________________________;步骤⑦是二茂铁粗产品的提纯,该过程在右图中进行,其操作名称为 ____________________________。
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是_________________________。
(6)最终得到纯净的二茂铁3.7g,则该实验的产率为 __________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属钯催化的偶联反应是近年来有机合成的热点之一,如反应①:

化合物II可由以下合成路线获得:
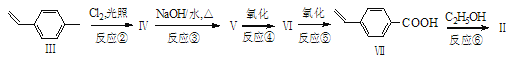
(1)化合物I所含官能团的名称为______________,化合物II的分子式为_____________。
(2)化合物IV的结构简式为______________________,某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物III氧化为化合物VII,该设想明显不合理,其理由是__________________________________________________________。
(3)化合物VII有多种同分异构体,请写出一种符合下列要求的结构简式____________。
i)苯环上有两个取代基
ii)1 mol 该物质发生银镜反应能生成4 mol Ag
(4)反应⑥的化学方程式为________________________________________。(注明条件)
(5)化合物![]() 与化合物
与化合物![]() 在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 用图1所示装置制取并收集少量纯净的氨气
B. 用图2 所示装置分离乙醇和乙酸乙酯的混合溶液
C. 用图3所示装置加热分解NaHCO3固体
D. 用图4 所示装置比较KMnO4、Cl2、Br2的氧化性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有7种物质:①干冰②金刚石③四氯化碳④晶体硅⑤过氧化钠⑥二氧化硅晶体⑦氯化铵(用序号回答)
(1)这些物质中熔点最高的是___________
(2)属于分子晶体的是___________,其中分子构型为正四面体的是___________,杂化类型为___________。
(3)属于离子晶体的是___________
(4)写出含有极性键和配位键的离子化合物的电子式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业、医药、农业等部门有许多用途。某工厂以铁硼精矿(主要成分为B2O3·2MgO,还有SiO2、CaO、FeO等杂质)制取制硼酸、金属镁的工艺流程图为:
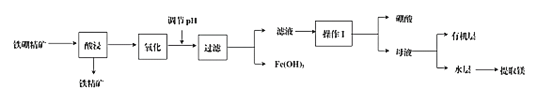
已知:硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
回答下列问题:
(1)使用盐酸酸浸,过程中主要反应的化学方程式为_________,为提高浸出速率,可采取的措施有_________(写出两条)。
(2)酸浸时,温度与硼浸出率的关系如图所示,则合适的酸浸温度为_________。

(3)浸出液“氧化”的是将溶液中的Fe2+用_______试剂氧化为Fe3+,反应的离子方程式为_________。
(4)从滤液中获得H3BO3晶体的“操作I”具体操作是_________。
(5)向滤液中加入有机萃取剂萃取分液,此时硼酸处于_________层中(填“有机”或“无机”)。实验室模拟萃取操作使用的玻璃仪器除烧杯外,另一主要玻璃仪器是_________。
(6)某工厂用 m1 kg的铁硼精矿制备硼酸,得到纯度为99.8%的硼酸m2 kg,则铁硼精矿中硼的质量分数是__________(列式表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com