
ЁОЬтФПЁПХ№МАЦфЛЏКЯЮядкЙЄвЕЁЂвНвЉЁЂХЉвЕЕШВПУХгааэЖргУЭОЁЃФГЙЄГЇвдЬњХ№ОЋПѓ(жївЊГЩЗжЮЊB2O3ЁЄ2MgOЃЌЛЙгаSiO2ЁЂCaOЁЂFeOЕШдгжЪ)жЦШЁжЦХ№ЫсЁЂН№ЪєУОЕФЙЄвеСїГЬЭМЮЊЃК
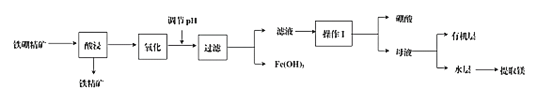
вбжЊЃКХ№ЫсдкВЛЭЌЮТЖШЯТЕФШмНтЖШЃК
ЮТЖШ(Ёц) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
ШмНтЖШ(g/100gЫЎ) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
ЛиД№ЯТСаЮЪЬтЃК
(1)ЪЙгУбЮЫсЫсНўЃЌЙ§ГЬжажївЊЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________ЃЌЮЊЬсИпНўГіЫйТЪЃЌПЩВЩШЁЕФДыЪЉга_________(аДГіСНЬѕ)ЁЃ
(2)ЫсНўЪБЃЌЮТЖШгыХ№НўГіТЪЕФЙиЯЕШчЭМЫљЪОЃЌдђКЯЪЪЕФЫсНўЮТЖШЮЊ_________ЁЃ

(3)НўГівКЁАбѕЛЏЁБЕФЪЧНЋШмвКжаЕФFe2+гУ_______ЪдМСбѕЛЏЮЊFe3+ЃЌЗДгІЕФРызгЗНГЬЪНЮЊ_________ЁЃ
(4)ДгТЫвКжаЛёЕУH3BO3ОЇЬхЕФЁАВйзїIЁБОпЬхВйзїЪЧ_________ЁЃ
(5)ЯђТЫвКжаМгШыгаЛњнЭШЁМСнЭШЁЗжвКЃЌДЫЪБХ№ЫсДІгк_________Вужа(ЬюЁАгаЛњЁБЛђЁАЮоЛњЁБ)ЁЃЪЕбщЪвФЃФтнЭШЁВйзїЪЙгУЕФВЃСЇвЧЦїГ§ЩеБЭтЃЌСэвЛжївЊВЃСЇвЧЦїЪЧ_________ЁЃ
(6)ФГЙЄГЇгУ m1 kgЕФЬњХ№ОЋПѓжЦБИХ№ЫсЃЌЕУЕНДПЖШЮЊ99.8%ЕФХ№Ысm2 kgЃЌдђЬњХ№ОЋПѓжаХ№ЕФжЪСПЗжЪ§ЪЧ__________(СаЪНБэДя)ЁЃ
ЁОД№АИЁПB2O3ЁЄ2MgO+4HCl+H2O=2H3BO3+2MgCl2 ЪЪЕБдіМгбЮЫсХЈЖШЁЂЬсИпЗДгІЮТЖШЁЂМѕаЁЬњХ№ПѓЗлСЃОЖЁЂГфЗжНСАшЕШ 90~95Ёц H2O2(ЛђCl2) 2Fe2++H2O2+2H+=2Fe3++2H2O(Лђ2Fe2++Cl2=2Fe3++2Cl-) еєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫ гаЛњ ЗжвКТЉЖЗ ![]() ЁС100%
ЁС100%
ЁОНтЮіЁП
бЮЫсгыЬњХ№ОЋПѓЕФжївЊГЩЗжB2O3ЁЄ2MgOЗЂЩњЗДгІВњЩњH3BO3ЁЂMgCl2ЃЌдгжЪCaOЁЂFeOвВЛсЗЂЩњЗДгІВњЩњCaCl2ЁЂFeCl2ЃЌЙ§ТЫГ§ШЅSiO2ЃЌШЛКѓЯђЗДгІКѓЕФШмвКжаМгШыH2O2ЛђЭЈШыCl2ЃЌЗЂЩњбѕЛЏЛЙдЗДгІЃЌFeCl2БфЮЊFeCl3ЃЌШЛКѓЕїНкШмвКpHЪЙFe3+ЗДгІзЊЛЏЮЊFe(OH)3ГСЕэЃЌЙ§ТЫГ§ШЅЃЌНсКЯХ№ЫсЕФШмНтЖШгыЮТЖШЕФЙиЯЕЃЌНЋХ№ЫсОЇЬхДгШмвКжаЗжРыГіРДЃЛЗжРыКѓЕФФИвКжаМгШыгаЛњЮянЭШЁЃЌЕУЕНЕФЫЎВужаКЌгаMg2+ЃЌЫЕУїХ№ЫсдкгаЛњВужаЃЌШЛКѓРћгУBдЊЫиЪиКуМЦЫуЬњХ№ОЋПѓжаХ№ЕФжЪСПЗжЪ§ЁЃ
(1)ЪЙгУбЮЫсЫсНўЙ§ГЬжажївЊЗДгІЮЊЬњХ№ОЋПѓЕФжївЊГЩЗжB2O3ЁЄ2MgOгыбЮЫсЗЂЩњЗДгІВњЩњH3BO3ЁЂMgCl2ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊB2O3ЁЄ2MgO+4HCl+H2O=2H3BO3+2MgCl2ЃЛЬњХ№ОЋПѓЪЧЙЬЬхЮяжЪЃЌЮЊЬсИпНўГіЫйТЪЃЌПЩВЩШЁЕФДыЪЉПЩвдНЋЬњХ№ОЋПѓЗлЫщЃЌвВПЩвдЬсИпЗДгІЮТЖШЁЂЪЙгУНЯДѓХЈЖШЕФбЮЫсЁЂЗДгІЙ§ГЬжаНСАшЕШЃЛ
(2)гЩЫсНўЪБЃЌЮТЖШгыХ№НўГіТЪЕФЙиЯЕЭМЪОПЩжЊЃЌдк90~95ЁцЪБХ№ЫсНўГіТЪзюИпЃЌЫљвдКЯЪЪЕФЫсНўЮТЖШЮЊ90~95ЁцЃЛ
(3)НўГівКЁАбѕЛЏЁБЕФЪЧШмвКжаЕФFe2+ЃЌдкбѕЛЏЙ§ГЬжаВЛФмв§ШыаТЕФдгжЪЃЌПЩвдЪЙгУH2O2ЃЌвВПЩвдЪЙгУCl2ЫЎЃЌЗДгІЗНГЬЪНЮЊЃК2Fe2++H2O2+2H+=2Fe3++2H2O(Лђ2Fe2++Cl2=2Fe3++2Cl-)ЃЛ
(4)гЩХ№ЫсЕФШмНтЖШгыЮТЖШЕФЙиЯЕПЩжЊЃКЮТЖШЩ§ИпЃЌХ№ЫсЕФШмНтЖШдіДѓЃЌЫљвдДгТЫвКжаЛёЕУH3BO3ОЇЬхЕФЁАВйзїIЁБОпЬхВйзїЪЧНЋИпЮТЯТЕФШмвКеєЗЂХЈЫѕЁЂШЛКѓРфШДНсОЇЁЂдйНјааЙ§ТЫПЩЕУЃЛ
(5)ЗжРыГіХ№ЫсОЇЬхКѓЕФТЫвКжаШдШЛКЌгавЛЖЈСПЕФХ№ЫсЃЌЯђИУШмвКМгШыгаЛњнЭШЁМСнЭШЁЗжвКЃЌгЩгкЕУЕНЕФЫЎВужаКЌгаПЩШмЕФMgCl2ЃЌЫЕУїХ№ЫсдкгаЛњЮяжаЃЌХ№ЫсШнвзШмНтдкИУгаЛњнЭШЁВужаЃЛЪЕбщЪвФЃФтнЭШЁВйзїЪЙгУЕФВЃСЇвЧЦїГ§ЩеБЭтЃЌСэвЛжївЊВЃСЇвЧЦїЪЧЗжвКТЉЖЗЃЛ
(6)ДПЖШЮЊ99.8%ЕФХ№Ысm2kgжаКЌгаBдЊЫиЕФжЪСПЮЊm(B)=![]() kgЃЌгЩгкВњЩњИУХ№ЫсашЯћКФm1kgЕФЬњХ№ОЋПѓЃЌ ЫљвдЬњХ№ОЋПѓжаХ№ЕФжЪСПЗжЪ§
kgЃЌгЩгкВњЩњИУХ№ЫсашЯћКФm1kgЕФЬњХ№ОЋПѓЃЌ ЫљвдЬњХ№ОЋПѓжаХ№ЕФжЪСПЗжЪ§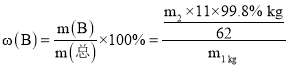 ЁС100%=
ЁС100%=![]() ЁС100%ЁЃ
ЁС100%ЁЃ


 ОйвЛЗДШ§ЭЌВНЧЩНВОЋСЗЯЕСаД№АИ
ОйвЛЗДШ§ЭЌВНЧЩНВОЋСЗЯЕСаД№АИ ПкЫугыгІгУЬтПЈЯЕСаД№АИ
ПкЫугыгІгУЬтПЈЯЕСаД№АИ УћЪІЕуОІзжДЪОфЖЮЦЊЯЕСаД№АИ
УћЪІЕуОІзжДЪОфЖЮЦЊЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЦјЪЧживЊЕФЛЏЙЄдСЯЁЃ
ЃЈ1ЃЉРћгУH2SжЦБИH2ЃЎвбШчЃКдкНЯЕЭЮТЖШЯТЗЂЩњЯТСаЗДгІЃК
ЂйH2S(g)+H2SO4(aq)ЈTS(s)+SO2(g)+2H2O(1) ЁїH1=+61kJmol-1
ЂкSO2(g)+I2(s)+2H2O(1)ЈT2HI(aq)+H2SO4(aq) ЁїH2=-151kJmol-1
Ђл2HI(aq)H2(g)+I2(s) ЁїH3=+110kJmol-1
ЂмH2S(g) H2(g)+S(s) ЁїH4=__kJmol-1ЁЃ
ЃЈ2ЃЉввЯЉЪЧКЯГЩЪГЦЗЭтАќзАВФСЯвЛОлввЯЉЕФЕЅЬхЁЃЙЄвЕЩЯРћгУH2КЭCO2ПЩвджЦБИввЯЉЃЌ2CO2(g)+6H2(l)C2H4(g)+4H2O(g) ЁїH
Ђйдк2LКуШнУмБеШнЦїжаЭЖШы4molCO2КЭamolH2ЃЌдкФГДпЛЏМСзїгУЯТЗЂЩњЩЯЪіЗДгІЃЌCO2ЕФзЊЛЏТЪгыЮТЖШЙиЯЕШчЭМ1ЫљЪОЁЃ
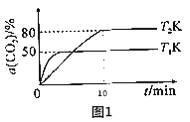
гЩЭМ1ХаЖЯЃЌT2__T1ЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉЃЛT2KЯТЃЌ0ЁЋ10minФкH2ЕФЦНОљЗДгІЫйТЪv(H2)=__molL-1min-1ЁЃ
ЂкВтЕУЕЅЮЛЪБМфФкC2H4ВњТЪгыЮТЖШЁЂЭЖСЯБШ![]() ЙиЯЕШчЭМ2ЫљЪОЁЃ
ЙиЯЕШчЭМ2ЫљЪОЁЃ
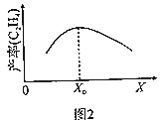
ШєXЮЊЮТЖШЃЌЕБЮТЖШИпгкX0ЪБЃЌЕЅЮЛЪБМфФкввЯЉВњТЪНЕЕЭЕФдвђПЩФмЪЧ__ЁЃ
ШєXЮЊЭЖСЯБШЃЌЕБ![]() ДѓгкX0ЪБЃЌввЯЉВњТЪНЕЕЭЕФдвђПЩФмЪЧ__ЁЃ
ДѓгкX0ЪБЃЌввЯЉВњТЪНЕЕЭЕФдвђПЩФмЪЧ__ЁЃ
ЂлдкФГЮТЖШЯТДяЕНЦНКтКѓЃЌдкt0ЪБжЛИФБфвЛИіЭтНчЬѕМўЃЌЗДгІЫйТЪЃЈvЃЉгыЪБМфЃЈtЃЉЕФЙиЯЕШчЭМ3ЫљЪОЁЃИФБфЕФЬѕМўПЩФмЪЧ___ЃЈЬюзжФИЃЉЁЃ

A.діДѓЗДгІЮяХЈЖШ
B.діДѓбЙЧП
C.Щ§ИпЮТЖШ
D.МгШыИпаЇДпЛЏМС
ЃЈ3ЃЉПЦбЇМввббаОПГіЩњЮяУИЃЌРћгУдЕчГидРэдкГЃЮТКЭЩњЮяУИзїгУЯТN2КЭH2КЯГЩNH3ЃЌМДH2дкИКМЋЩЯЗЂЩњбѕЛЏЗДгІЃЌH+ЭЈЙ§жЪзгНЛЛЛФЄЧЈвЦЕНе§МЋЧјЃЌе§МЋЩЯКЯГЩNH3ЁЃе§МЋЕФЕчМЋЗДгІЪНЮЊ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЉЮяжаМфЬхQЁЂвНгУВФСЯPVAЕФКЯГЩТЗЯпШчЯТЁЃ
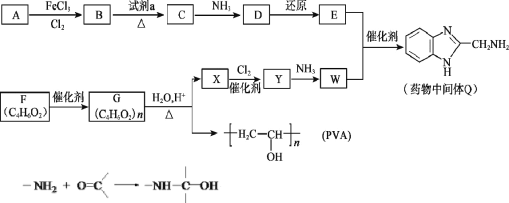
вбжЊЃК
ЃЈ1ЃЉAЕФЗжзгЪНЪЧC6H6ЃЌAЁњBЕФЗДгІРраЭЪЧ_______ЁЃ
ЃЈ2ЃЉBЁњCЪЧЯѕЛЏЗДгІЃЌЪдМСaЪЧ_______ЁЃ
ЃЈ3ЃЉCЁњDЮЊШЁДњЗДгІЃЌЦфЛЏбЇЗНГЬЪНЪЧ_______ЁЃ
ЃЈ4ЃЉFКЌгаЕФЙйФмЭХЪЧ________ЁЃ
ЃЈ5ЃЉFЕФКЌгаЬМЬМЫЋМќКЭѕЅЛљЕФЭЌЗжвьЙЙЬхга_____жжЃЈКЌЫГЗДвьЙЙЬхЃЌВЛКЌFЃЉЃЌЦфжаКЫДХЙВеёЧтЦзга3зщЮќЪеЗхЃЌЧвФмЗЂЩњвјОЕЗДгІЕФНсЙЙМђЪНЪЧ___ЃЎ
ЃЈ6ЃЉGЁњXЕФЛЏбЇЗНГЬЪНЪЧ________ЁЃ
ЃЈ7ЃЉWФмЗЂЩњОлКЯЗДгІЃЌаЮГЩЕФИпЗжзгНсЙЙМђЪНЪЧ________ЁЃ
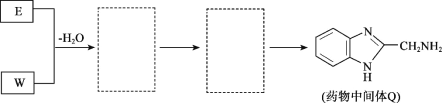
ЃЈ8ЃЉНЋЯТСаE+WЁњQЕФСїГЬЭМВЙГфЭъећЃЈдкащЯпПђФкаДГіЮяжЪЕФНсЙЙМђЪНЃЉЃК_________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПK2Cr2O7ШмвКжаДцдкЦНКтЃКCr2O72Љ(ГШЩЋ)+H2O2CrO42Љ(ЛЦЩЋ)+2H+.вбжЊCr2O72ЉгаЧПбѕЛЏадЃЌЖјCrO42ЉдђМИКѕУЛгабѕЛЏадЃЌCr3+ГЪТЬЩЋЁЃЯђK2Cr2O7ШмвКжаМгШывдЯТЮяжЪЃЌЙигкШмвКбеЩЋБфЛЏЕФЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
A.Мг70%ЕФСђЫсЃЌШмвКБфГШЩЋ
B.Мг30%NaOHШмвКЃЌШмвКБфЛЦЩЋ
C.Мг70%ЕФСђЫсКѓдйМгC2H5OHЃЌШмвКПЩБфГЩТЬЩЋ
D.Мг30%NaOHШмвККѓЃЌШмвКБфЛЦЩЋЃЌМгC2H5OHЮоБфЛЏЃЌдйМгЙ§СПСђЫсЃЌШмвКШдЮоУїЯдБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬМКЭСђЪЧИпжаЛЏбЇбЇЯАЕФСНжжживЊЗЧН№ЪєдЊЫи
(1)ЯТСаCдзгЕФЕчзгХХВМЪНБэДяЕФзДЬЌжаФмСПзюИпЕФЪЧ_____ЁЃ
A 1s22s22p2 B.1s22s22px12py1 C.1s22s22px12pz1 D.1s22s12px12py12pz1
(2)СђгавЛжжНсЙЙЮЊ![]() ЕФЗжзг(ЛвЧђДњБэСђдзг)ЁЃЦфжаСђдзгдгЛЏЗНЪНЮЊ_____ЁЃ
ЕФЗжзг(ЛвЧђДњБэСђдзг)ЁЃЦфжаСђдзгдгЛЏЗНЪНЮЊ_____ЁЃ
(3)Fe(CO)5ПЩгУзїДпЛЏМСЁЂЦћгЭПЙБЌМСЕШЃЌЦфЗжзгжаІвМќКЭІаМќЕФЪ§ФПжЎБШЮЊ_____ЁЃ
(4)вбжЊCS2ОЇЬхНсЙЙРрЫЦгкИЩБљЁЃCS2ОЇЬхжагыУПИіCS2ЗжзгОрРызюНќЧвЕШОрЕФCS2Зжгшга_____ИіЁЃЭЦВтCS2ОЇЬхУмЖШгыБљЕФОЇЬхУмЖШНЯДѓЕФЮЊ_____ЁЃПЩФмЕФдвђЪЧ_____ЁЃгжжЊCS2ОЇЬхжаОЇАћВЮЪ§ЪЧapmЃЌNAБэЪОАЂЗ№МгЕТТоГЃЪ§ЕФжЕЃЌОЇЬхУмЖШЮЊ_____g/cm3(гУКЌaЁЂNAЕШЗћКХЕФБэДяЪНБэЪО)ЁЃ
(5)Na2SЪЧИпзгОЇЬхЃЌЦфОЇИёФмПЩЭЈЙ§ЭМЕФBornЉHaberбЛЗМЦЫуЕУЕНЁЃ
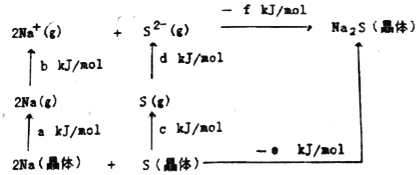
гЩДЫПЩжЊЃЌNaдзгЕФЕквЛЕчРыФмЮЊ_____kJ/molЃЌNa2SЕФОЇИёФмЮЊ_____kJ/molЁЃ(гУЭМжаИјГіЕФЗћКХзїД№)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБэДяЗНЪНЛђЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ЛљЬЌЕНМЄЗЂЬЌВњЩњЕФЙтЦзЪЧЗЂЩфЙтЦз
B. ТШЛЏяЇЕФЕчзгЪНЃК
C. NH3ЁЂH2OЁЂCO2ЁЂHCl ЫФЗжзгжаЙТЕчзгЖдзюЖрЕФЪЧ CO2
D. СђРызгЕФКЫЭтЕчзгХХВМЪН 1s22s22p63s23p4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЙАЉвЉЮяЕФНсЙЙМђЪНШчЭМЫљЪОЃЌЦфжаWЁЂXЁЂYЁЂZЪЧдзгађЪ§вРДЮдіДѓЕФЖЬжмЦкжїзхдЊЫиЃЌWЁЂYЭЌжїзхЃЌYЁЂZЕФзюЭтВуЕчзгЪ§жЎКЭЪЧXЕФзюЭтВуЕчзгЪ§ЕФ2БЖЁЃЯТСаа№Ъіе§ШЗЕФЪЧ
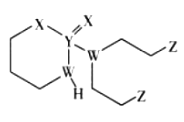
A.дЊЫиЕФЗЧН№ЪєадЃКW>Z>X
B.YЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЪЧЧПЫс
C.WЕФзюМђЕЅЧтЛЏЮягыZЕФЕЅжЪЛьКЯКѓПЩВњЩњАзбЬ
D.YЁЂZаЮГЩЕФЛЏКЯЮяжаЃЌУПИідзгОљТњзу8ЕчзгНсЙЙ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫФЕтЛЏЮ§ЪЧвЛжжГШКьЩЋНсОЇЃЌШлЕуЮЊ144ЃЎ5ЁцЃЌЗаЕуЮЊ364ЁцЃЌВЛШмгкРфЫЎЃЌШмгкДМЁЂБНЁЂТШЗТЕШЃЌгіЫЎвзЫЎНтЃЌГЃгУзїЗжЮіЪдМСКЭгаЛњКЯГЩЪдМСЁЃЪЕбщЪвжЦБИЫФЕтЛЏЮ§ЕФжївЊВНжшШчЯТЃК
ВНжш1ЃКдкИЩдяЕФдВЕзЩеЦПжаМгШыЩйСПЫщЮ§ВКЭЩдЙ§СПЕФI2ЃЌдйМгШы30mLБљДзЫсКЭ30mLДзЫсєћ[(CH3CO)2O]ЁЃЪЕбщзАжУШчЭМЫљЪОЃЌзщзАКУКѓгУУКЦјЕЦМгШШжСЗаЬкдМ1-1ЃЎ5hЃЌжСЗДгІЭъГЩЃЛ
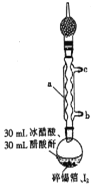
ВНжш2ЃКРфШДНсОЇЃЌЙ§ТЫЕУЕНЫФЕтЛЏЮ§ДжЦЗЃЛ
ВНжш3ЃКДжЦЗжаМгШы30mLТШЗТЃЌЫЎдЁМгШШЛиСїШмНтКѓЃЌГУШШЙ§ТЫЃЛ
ВНжш4ЃКНЋТЫвКЕЙШыеєЗЂУѓжаЃЌжУгкЭЈЗчГїФкЃЌД§ТШЗТШЋВПЛгЗЂКѓЕУЕНЫФЕтЛЏЮ§ОЇЬхЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЭМжавЧЦїaЕФУћГЦЮЊ__________ЃЛРфШДЫЎДгНгПк__________(ЬюЁАbЁБЛђЁАcЁБ)НјШыЁЃ
ЃЈ2ЃЉвЧЦїaЩЯСЌНгзАгаЮоЫЎCaCl2ЕФИЩдяЙмЕФФПЕФЪЧ__________ЃЛЮ§ВашМєЫщЕФФПЕФЪЧ__________ЃЛМгШыДзЫсєћЕФФПЕФЪЧ__________ЁЃ
ЃЈ3ЃЉЩеЦПжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________ЃЛЕЅжЪЕташЙ§СПЕФжївЊФПЕФЪЧ__________ЁЃ
ЃЈ4ЃЉЗДгІвбЕНжеЕуЕФЯжЯѓЪЧ__________ЁЃ
ЃЈ5ЃЉВНжш3КЭВНжш4ЕФФПЕФЪЧ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУШчЭМзАжУжЦШЁввЫсввѕЅЁЃ
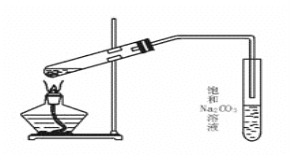
ЃЈ1ЃЉМгШШЧАЃЌДѓЪдЙмжаМгШыМИСЃЫщДЩЦЌЕФзїгУЪЧ___ЃЌЕМЦјЙмВЛФмВхШыБЅКЭNa2CO3ШмвКжаЪЧЮЊСЫ___ЁЃ
ЃЈ2ЃЉБЅКЭNa2CO3ШмвКЕФзїгУЪЧ___ЁЂ___ЁЂ___ЁЃ
ЃЈ3ЃЉЪЕбщЪвЩњГЩЕФввЫсввѕЅЃЌЦфУмЖШБШЫЎ___(ЬюЁАДѓЁБЛђЁАаЁЁБ)ЃЌга___ЦјЮЖЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com