
【题目】某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍。下列叙述正确的是
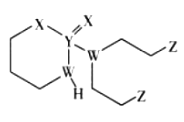
A.元素的非金属性:W>Z>X
B.Y的最高价氧化物的水化物是强酸
C.W的最简单氢化物与Z的单质混合后可产生白烟
D.Y、Z形成的化合物中,每个原子均满足8电子结构
【答案】C
【解析】
由分子结构可知Y形成5个共价键,则Y原子最外层有5个电子,由于W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,则W是N,Y是P,Y、Z的最外层电子数之和是X的最外层电子数的2倍,P最外层有5个电子,Z最外层电子数也是奇数,X最外层电子数为偶数,结合都是短周期元素,则Z是Cl最外层有7个电子,所以X最外层电子数为(5+7)÷2=6,原子序数比P小中,则X是O元素,然后分析解答。
根据上述分析可知:W是N,X是O,Y是P,Z是Cl元素。
A.元素的非金属性:O>N,即X>W,A错误;
B.Y是P,P的最高价氧化物的水化物是H3PO4是弱酸,B错误;
C.W是N,Z是Cl,W的最简单氢化物NH3与Z的单质Cl2混合后会发生氧化还原反应:8NH3+3Cl2=6NH4Cl+N2,反应产生的NH4Cl在室温下呈固态,因此可看到产生白烟现象,C正确;
D.Y是P,Z是Cl,二者可形成PCl3、PCl5,其中PCl3中每个原子均满足8电子结构,而PCl5中P原子不满足8电子结构,D错误;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 用图1所示装置制取并收集少量纯净的氨气
B. 用图2 所示装置分离乙醇和乙酸乙酯的混合溶液
C. 用图3所示装置加热分解NaHCO3固体
D. 用图4 所示装置比较KMnO4、Cl2、Br2的氧化性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将浸透了石蜡油的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,关于该实验的分析正确的是( )

A.石棉的作用是催化剂
B.碎瓷片的作用是防暴沸
C.若小试管中的液体是酸性高锰酸钾,则其褪色的原因是石蜡油挥发
D.若小试管中的液体是溴水,一段时间后会观察到其褪色并分层
查看答案和解析>>
科目:高中化学 来源: 题型:
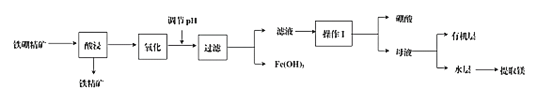
【题目】硼及其化合物在工业、医药、农业等部门有许多用途。某工厂以铁硼精矿(主要成分为B2O3·2MgO,还有SiO2、CaO、FeO等杂质)制取制硼酸、金属镁的工艺流程图为:
已知:硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
回答下列问题:
(1)使用盐酸酸浸,过程中主要反应的化学方程式为_________,为提高浸出速率,可采取的措施有_________(写出两条)。
(2)酸浸时,温度与硼浸出率的关系如图所示,则合适的酸浸温度为_________。

(3)浸出液“氧化”的是将溶液中的Fe2+用_______试剂氧化为Fe3+,反应的离子方程式为_________。
(4)从滤液中获得H3BO3晶体的“操作I”具体操作是_________。
(5)向滤液中加入有机萃取剂萃取分液,此时硼酸处于_________层中(填“有机”或“无机”)。实验室模拟萃取操作使用的玻璃仪器除烧杯外,另一主要玻璃仪器是_________。
(6)某工厂用 m1 kg的铁硼精矿制备硼酸,得到纯度为99.8%的硼酸m2 kg,则铁硼精矿中硼的质量分数是__________(列式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序: _____________________;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________,若将其溶于水,破坏了其中的__________(填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4:1反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物分子的叙述不正确的是( )
A. 乙烯分子中有一个sp2-sp2σ键和一个p-p π键
B. 乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C. 乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D. 苯分子每个碳原子均是sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构,请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1 817 | 2 745 | 11 578 |
B | 738 | 1 451 | 7 733 | 10 540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
共价键 | C—C | C—N | C—S |
键能/kJ·mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3 401 |

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填序号)。
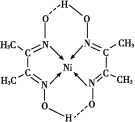
A离子键;B极性键;C金属键;D配位键;E氢键;F非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟磷酸锂(LiPF6)极易溶于水,可溶于醇等有机溶剂,常作锂离子电池的电解质。某工氟磷灰石[Ca5(PO4)3F]为主要原料,制备六氟磷酸锂的流程如下:
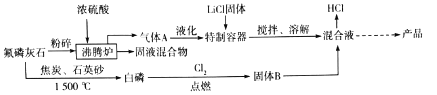
已知:HF的熔点为-83℃,沸点为19.5℃
回答下列问题:
(1)粉碎氟磷灰石的目的是________________________
(2)特制容器不能用玻璃容器,原因是________________(用文字叙述)
(3)沸腾炉中产生固液混合物,该混合物中含有CaSO4和________(除硫酸外)
(4)制备白磷(P4)中产生SiF4和一种还原性气体,制备白磷的化学方程式为________________
(5)尾气中PCl5用足量的烧碱溶液吸收生成两种盐,写出发生反应的离子方程式:________________
(6)如果42.5kgLiCl参与反应,理论上可制备________kgLiPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于加成反应的是
A.CH2=CH2 + Br2→CH2BrCH2Br
B.2CH3CH2OH +O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
C.CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
D.CH4 + 2O2![]() CO2 + 2H2O
CO2 + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com