
����Ŀ�������������ʵ���Ҫ���������ʽṹ,��ش��������⡣
(1)��֪A��BΪ��������Ԫ��,��ԭ�ӵĵ�һ�����ĵ��������±���ʾ:
������/kJ��mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1 817 | 2 745 | 11 578 |
B | 738 | 1 451 | 7 733 | 10 540 |
Aͨ���� ��,A�ĵ縺�� B�ĵ縺��(��������������������=��)��
(2)�����Ĺ��������е�����ԼΪ399 kJ��mol-1�������±��йص����ʷ�������Ҫ��ѧ������Ϣ,˵�����峤ʱ������������Ƥ�������˺���ԭ�� ��
��ɵ����ʵ���İ������е�̼ԭ���ӻ������� ��
���ۼ� | C��C | C��N | C��S |
����/kJ��mol-1 | 347 | 305 | 259 |
(3)ʵ��֤��:KCl��MgO��CaO��TiN��4�־���Ľṹ��NaCl����ṹ����(��ͼ��ʾ),��֪3�����Ӿ���ľ������������±�:
���Ӿ��� | NaCl | KCl | CaO |
������/kJ��mol-1 | 786 | 715 | 3 401 |

���4�����Ӿ���(������NaCl)�۵�Ӹߵ��͵�˳����: ������MgO������һ��Mg2+��Χ�������ڽ��ҵȾ����Mg2+�� ����
(4)���������Ӻ�δ�ɶԵ���Խ��,�����Խ��,�ż�¼����Խ�á�������������V2O5��CrO2��,�ʺ���¼�����ŷ�ԭ�ϵ��� ��
(5)ij�����ķ��ӽṹ��ͼ��ʾ,������ڲ����� (�����)��
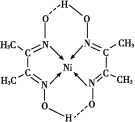
A���Ӽ���B���Լ���C��������D��λ����E�����F�Ǽ��Լ�
���𰸡�(1)+3 ��
(2)�������е������ȵ����ʷ�������Ҫ��ѧ��C��C��C��N��C��S�ļ��ܶ���,��������������ʹ��Щ��ѧ������,�Ӷ��ƻ������ʷ��� sp2��sp3
(3)TiN��MgO��CaO��KCl 12
(4)CrO2
(5)C
��������(1)����A�ĵ�4������ͻȻ����ܶ�,Aͨ����ʾ+3��;����B�ĵ�3������ͻȻ����,���ж�Bͨ����ʾ+2��,�������ڱ���,A��B���ұ�,��A�ĵ縺�Դ���B��
(2)���ݱ������ݿ�֪�������������е��������ڵ������и��ֻ�ѧ���ļ���,����������ƻ��������л�ѧ�������ƻ������ʡ�
(3)���Ӿ��徧����Խ��,�۷е�Խ�ߡ������������������������ĵ�ɵij˻�������,����������֮��ľ���ɷ���,�ҵ�ɵ�Ӱ�����,TN���������Ӹ���3����λ���,CaO�и���2����λ���,MgO�и���2����λ���,KCl�и���1����λ���,���۷е�ߵ�Ϊ:TN��MgO��CaO��KCl��������ĺڵ����Mg2+,��ÿ������е����,����12����
(4)V�ļ۵����Ų�Ϊ3d34s2,��V5+û��δ�ɶԵ���,��Cr�ļ۵����Ų�Ϊ3d54s1,��Cr4+��2��δ�ɶԵĵ���,��CrO2��Ϊ¼�����ŷ�ԭ�ϡ�
(5)����ͼʾ�ɿ���,OΪ������,��һ����λ�����,�ʺ����Ӽ�;N��Ni֮�������λ��,O��H֮�������Ϊ���,N��C��C��H��֮���Ǽ��Թ��ۼ�,C��C֮��Ϊ�Ǽ��Թ��ۼ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA�ǰ����ӵ�������ֵ������˵����ȷ����
A.�ܱ������У�2molNO��1molO2��Ӧ���������Ϊ2NA
B.1mol����1mol������ȼ�գ�ת�Ƶĵ�����Ϊ3NA
C.�ڱ�״���£�4.48L������ȴ�����Ӻ�ԭ����ĿΪNA
D.һ�������£�2.3gNa��O2��ȫ��Ӧ����3.6g����ʱʧȥ�ĵ�����0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�����Ǹ��л�ѧѧϰ��������Ҫ�ǽ���Ԫ��
(1)����Cԭ�ӵĵ����Ų�ʽ�����״̬��������ߵ���_____��
A 1s22s22p2 B.1s22s22px12py1 C.1s22s22px12pz1 D.1s22s12px12py12pz1
(2)����һ�ֽṹΪ![]() �ķ���(���������ԭ��)��������ԭ���ӻ���ʽΪ_____��
�ķ���(���������ԭ��)��������ԭ���ӻ���ʽΪ_____��
(3)Fe(CO)5���������������Ϳ������ȣ����������������������Ŀ֮��Ϊ_____��
(4)��֪CS2����ṹ�����ڸɱ���CS2��������ÿ��CS2���Ӿ�������ҵȾ��CS2������_____�����Ʋ�CS2�����ܶ�����ľ����ܶȽϴ��Ϊ_____�����ܵ�ԭ����_____����֪CS2�����о���������apm��NA��ʾ����ӵ�������ֵ�������ܶ�Ϊ_____g/cm3(�ú�a��NA�ȷ��ŵı���ʽ��ʾ)��
(5)Na2S�Ǹ��Ӿ��壬�侧���ܿ�ͨ��ͼ��Born��Haberѭ������õ���
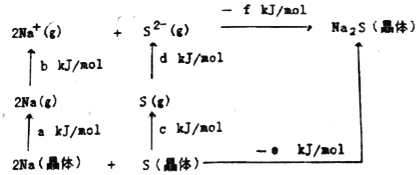
�ɴ˿�֪��Naԭ�ӵĵ�һ������Ϊ_____kJ/mol��Na2S�ľ�����Ϊ_____kJ/mol��(��ͼ�и����ķ�������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ҩ��Ľṹ��ʽ��ͼ��ʾ������W��X��Y��Z��ԭ��������������Ķ���������Ԫ�أ�W��Yͬ���壬Y��Z������������֮����X��������������2��������������ȷ����
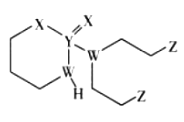
A.Ԫ�صķǽ����ԣ�W>Z>X
B.Y������������ˮ������ǿ��
C.W������⻯����Z�ĵ��ʻ�Ϻ�ɲ�������
D.Y��Z�γɵĻ������У�ÿ��ԭ�Ӿ�����8���ӽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaCO3�㷺��������Ȼ�磬��һ����Ҫ�Ļ���ԭ�ϡ�����ʯ��Ҫ�ɷ�ΪCaCO3�������������ĺ����ʵ�����ô���ʯ��ϡ���ᷴӦ�Ʊ�CO2���塣����װ�ÿ�����CO2������ᴿ������������գ�
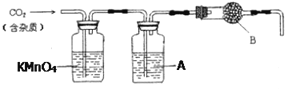
��1����Ũ��������1:1������ȣ���ϡ���ᣨԼ6 mol��L-1������Ҫ�IJ���������___________
��2������װ���У�A��___________��Һ����������___________ ��
��3������װ���У�B������___________��
��4��һ���Է�����ʯ����CaCO3��ʳ���е��ܳ��������۷���������ָ��֮һ���ⶨ�ܳ�������Ҫʵ�鲽��������£����顢���ء������ܽ�����ˡ�������ɡ���ȴ�����ء�����
�ٴ����ʷ���ĽǶȷ�����ʯ�������л����е�____________�࣬Ϊ�˽�ʯ���ӷ������ܳ���Ӧѡ�������Լ��е�__________��
a���Ȼ�����Һ b��ϡ���� c��ϡ���� d ������
�ڷ����е�̼��Ƴ���ϡ���Ὣ���ܳ�����д���䷴Ӧ�����ӷ���ʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ĵ⻯����һ�ֳȺ�ɫ�ᾧ���۵�Ϊ144��5�����е�Ϊ364������������ˮ�����ڴ��������ȷµȣ���ˮ��ˮ�⣬�����������Լ����л��ϳ��Լ���ʵ�����Ʊ��ĵ⻯������Ҫ�������£�
����1���ڸ����Բ����ƿ�м����������������Թ�����I2���ټ���30mL�������30mL������[(CH3CO)2O]��ʵ��װ����ͼ��ʾ����װ�ú���ú���Ƽ���������Լ1-1��5h������Ӧ��ɣ�
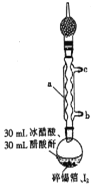
����2����ȴ�ᾧ�����˵õ��ĵ⻯����Ʒ��
����3����Ʒ�м���30mL�ȷ£�ˮԡ���Ȼ����ܽ���ȹ��ˣ�
����4������Һ�����������У�����ͨ����ڣ����ȷ�ȫ���ӷ���õ��ĵ⻯�����塣
�ش��������⣺
��1��ͼ������a������Ϊ__________����ȴˮ�ӽӿ�__________(����b������c��)���롣
��2������a������װ����ˮCaCl2�ĸ���ܵ�Ŀ����__________������������Ŀ����__________�������������Ŀ����__________��
��3����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ__________�����ʵ����������ҪĿ����__________��
��4����Ӧ�ѵ��յ��������__________��
��5������3�Ͳ���4��Ŀ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008���˼����︣�ޣ������Ϊ����ë�ߣ��ڳ���Ϊ���ľ�����ά(��ͼ)������˵����ȷ���ǣ� ��

A.��ë�������ά�Ļ�ѧ�ɷ���ͬ
B.������ά����ëһ�������¾���ˮ��
C.�þ�����ά�ĵ���Ϊ�Ա���������Ҵ�
D.������ά���ڴ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ(Cu2O)�������մɡ��������������������з�Ӧ�Ʊ���2(CuSO4H2O)![]() Cu2O+SO2��+SO3��+O2��+10H2O���ش��������⣺
Cu2O+SO2��+SO3��+O2��+10H2O���ش��������⣺
(1)Cu2O�л�̬ͭ�����ӵļ۲�����Ų�ͼΪ________________��������Ӧ�У��縺������Ԫ����________________����Ԫ�ط���)
(2)Ԫ��Cu��Ni���ڣ����һ�������������������ʾ��
I1/(kJ/mol) | I2/(kJ/mol) | |
Ni | 737.1 | 1753.0 |
Cu | 745.5 | 1957.9 |
ͭ�ĵ�һ���������ܶ�������Ӧ�ĸߣ���ԭ�����ͭ�ĺ˵�����ȶ࣬������ӵ����������⣬����һ��ԭ����________��
(3)��֪H2SO4�Ľṹʽ��ͼ��ʾ,������Ӧ�У�

�������������У�VSEPRģ����SO42-��ͬ����________(�ѧʽ)
��SO3���ӵ����幹����________________��д��һ����SO3��Ϊ�ȵ���������ӣ�________�������ӷ���)
(4)Cu2+��Cu+��CN-��OH-��NH3��H2O����ɶ��������ӡ�[Cu(NH3)4]2+�е�Cu2+��λ��Ϊ________��
(5)ͭԪ�غ���Ԫ���һ�־���M��M�ľ�����ͼ��ʾ��

��֪��NA�ǰ����ӵ�������ֵ��M�����ܶ�Ϊdgcm-3��M�ľ�����Cu+��Cl-������Ϊ________����������Ϊ________pm(�ú�d��NA�Ĵ���ʽ��ʾ)��(�ú�d��NA�Ĵ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧϰ�У�ͬѧ������������пƬ��ͭƬ�����ߡ������ơ�����֭��������̽��ԭ��ص���ɣ����н��۲���ȷ����
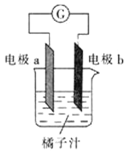
A.��aΪ��Ƭ��bΪпƬ��ͭƬ��������һ����������
B.��aΪпƬ��bΪ��Ƭ����b���ϵĵ缫��ӦʽΪ![]()
C.ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ��
D.��a��b��Ϊ��Ƭ���������ָ�벻ƫת
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com