
【题目】四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂。实验室制备四碘化锡的主要步骤如下:
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;
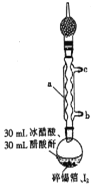
步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。
回答下列问题:
(1)图中仪器a的名称为__________;冷却水从接口__________(填“b”或“c”)进入。
(2)仪器a上连接装有无水CaCl2的干燥管的目的是__________;锡箔需剪碎的目的是__________;加入醋酸酐的目的是__________。
(3)烧瓶中发生反应的化学方程式为__________;单质碘需过量的主要目的是__________。
(4)反应已到终点的现象是__________。
(5)步骤3和步骤4的目的是__________。
【答案】(1)冷凝管;b;(2)防止空气中水蒸气进入反应器中;增大与I2的接触面,加快反应速率;除去体系中的水,防止四碘化锡水解;
(3)Sn+2I2![]() SnI4;防止锡屑混入四碘化锡晶体中(或使锡反应完全)
SnI4;防止锡屑混入四碘化锡晶体中(或使锡反应完全)
(4)紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色(5)提纯SnI4产品。
【解析】
试题(1)图中仪器a是球形冷凝管;根据上进下出的原则,冷却水从接口b进入,故答案为:冷凝管;b;
(2)无水CaCl2是常见的干燥剂,仪器a上连接装有无水CaCl2的干燥管的是为了防止空气中水蒸气进入反应器中;为了提高反应速率,常将锡箔需剪碎,以增大与I2的接触面;根据题意,四碘化锡遇水易水解,加入醋酸酐可以除去体系中的水,防止四碘化锡水解,故答案为:防止空气中水蒸气进入反应器中;增大与I2的接触面,加快反应速率;除去体系中的水,防止四碘化锡水解;
(3)烧瓶中Sn和I2发生反应生成四碘化锡,反应的化学方程式为Sn+2I2![]() SnI4;为了提高锡的利用率,和防止锡屑混入四碘化锡晶体中,单质碘需过量,故答案为:Sn+2I2
SnI4;为了提高锡的利用率,和防止锡屑混入四碘化锡晶体中,单质碘需过量,故答案为:Sn+2I2![]() SnI4;防止锡屑混入四碘化锡晶体中(或使锡反应完全)
SnI4;防止锡屑混入四碘化锡晶体中(或使锡反应完全)
(4)反应结束,装置中将不在含有碘蒸气,生成的四碘化锡使溶液呈现橙红色,故答案为:紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色;
(5)步骤3和步骤4的目的是除去四碘化锡中的杂质,故答案为:提纯SnI4产品。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】现有7种物质:①干冰②金刚石③四氯化碳④晶体硅⑤过氧化钠⑥二氧化硅晶体⑦氯化铵(用序号回答)
(1)这些物质中熔点最高的是___________
(2)属于分子晶体的是___________,其中分子构型为正四面体的是___________,杂化类型为___________。
(3)属于离子晶体的是___________
(4)写出含有极性键和配位键的离子化合物的电子式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
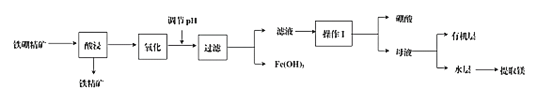
【题目】硼及其化合物在工业、医药、农业等部门有许多用途。某工厂以铁硼精矿(主要成分为B2O3·2MgO,还有SiO2、CaO、FeO等杂质)制取制硼酸、金属镁的工艺流程图为:
已知:硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
回答下列问题:
(1)使用盐酸酸浸,过程中主要反应的化学方程式为_________,为提高浸出速率,可采取的措施有_________(写出两条)。
(2)酸浸时,温度与硼浸出率的关系如图所示,则合适的酸浸温度为_________。

(3)浸出液“氧化”的是将溶液中的Fe2+用_______试剂氧化为Fe3+,反应的离子方程式为_________。
(4)从滤液中获得H3BO3晶体的“操作I”具体操作是_________。
(5)向滤液中加入有机萃取剂萃取分液,此时硼酸处于_________层中(填“有机”或“无机”)。实验室模拟萃取操作使用的玻璃仪器除烧杯外,另一主要玻璃仪器是_________。
(6)某工厂用 m1 kg的铁硼精矿制备硼酸,得到纯度为99.8%的硼酸m2 kg,则铁硼精矿中硼的质量分数是__________(列式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物分子的叙述不正确的是( )
A. 乙烯分子中有一个sp2-sp2σ键和一个p-p π键
B. 乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C. 乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D. 苯分子每个碳原子均是sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构,请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1 817 | 2 745 | 11 578 |
B | 738 | 1 451 | 7 733 | 10 540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
共价键 | C—C | C—N | C—S |
键能/kJ·mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3 401 |

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填序号)。
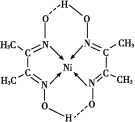
A离子键;B极性键;C金属键;D配位键;E氢键;F非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.35Cl与37Cl互为同素异形体
B.O2与O3互为同位素
C.![]() 与CH3CH2CH2CH3互为同分异构体
与CH3CH2CH2CH3互为同分异构体
D.乙烯与CH3—C≡CH互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
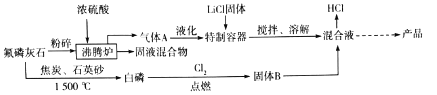
【题目】六氟磷酸锂(LiPF6)极易溶于水,可溶于醇等有机溶剂,常作锂离子电池的电解质。某工氟磷灰石[Ca5(PO4)3F]为主要原料,制备六氟磷酸锂的流程如下:
已知:HF的熔点为-83℃,沸点为19.5℃
回答下列问题:
(1)粉碎氟磷灰石的目的是________________________
(2)特制容器不能用玻璃容器,原因是________________(用文字叙述)
(3)沸腾炉中产生固液混合物,该混合物中含有CaSO4和________(除硫酸外)
(4)制备白磷(P4)中产生SiF4和一种还原性气体,制备白磷的化学方程式为________________
(5)尾气中PCl5用足量的烧碱溶液吸收生成两种盐,写出发生反应的离子方程式:________________
(6)如果42.5kgLiCl参与反应,理论上可制备________kgLiPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物分子中所有的原子不可能都处于同一平面的是( )
A.C6H5—CH=CH—CHOB.CF2=CF2
C.CH3—O—CH3D.HC≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科技大学改进Pd/Al2O3催化H2还原CO2制备甲醇的生产工艺,其机理如图所示,下列说法不正确的是( )
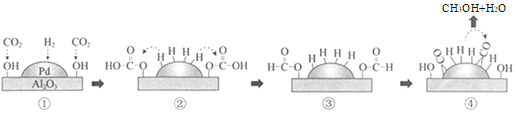
A.金属钯是优良的贮氢材料
B.①→②为CO2发生加成反应
C.④中CO被氧化为CH3OH
D.生成甲醇的总反应方程式是CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com