
ЁОЬтФПЁПСљЗњСзЫсяЎ(LiPF6)МЋвзШмгкЫЎЃЌПЩШмгкДМЕШгаЛњШмМСЃЌГЃзїяЎРызгЕчГиЕФЕчНтжЪЁЃФГЙЄЗњСзЛвЪЏ[Ca5(PO4)3F]ЮЊжївЊдСЯЃЌжЦБИСљЗњСзЫсяЎЕФСїГЬШчЯТЃК
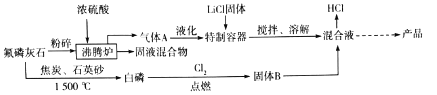
вбжЊЃКHFЕФШлЕуЮЊ-83ЁцЃЌЗаЕуЮЊ19.5Ёц
ЛиД№ЯТСаЮЪЬтЃК
(1)ЗлЫщЗњСзЛвЪЏЕФФПЕФЪЧ________________________
(2)ЬижЦШнЦїВЛФмгУВЃСЇШнЦїЃЌдвђЪЧ________________(гУЮФзжа№Ъі)
(3)ЗаЬкТЏжаВњЩњЙЬвКЛьКЯЮяЃЌИУЛьКЯЮяжаКЌгаCaSO4КЭ________(çѐЫсЭт)
(4)жЦБИАзСз(P4)жаВњЩњSiF4КЭвЛжжЛЙдадЦјЬхЃЌжЦБИАзСзЕФЛЏбЇЗНГЬЪНЮЊ________________
(5)ЮВЦјжаPCl5гУзуСПЕФЩеМюШмвКЮќЪеЩњГЩСНжжбЮЃЌаДГіЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК________________
(6)ШчЙћ42.5kgLiClВЮгыЗДгІЃЌРэТлЩЯПЩжЦБИ________kgLiPF6
ЁОД№АИЁПдіДѓНгДЅУцЛ§ЃЌМгПьЗДгІЫйТЪ HFФмгыВЃСЇЛђЬеДЩвЧЦїжаЕФЖўбѕЛЏЙшЗДгІ H3PO4 4Ca5(PO4)3F+21SiO2+30C![]() 20CuSiO3+3P4+SiF4Ёќ+30COЁќ PCl5+8OH-=PO43-+5Cl-+4H2O 152
20CuSiO3+3P4+SiF4Ёќ+30COЁќ PCl5+8OH-=PO43-+5Cl-+4H2O 152
ЁОНтЮіЁП
ЗњСзЛвЪЏЗлЫщКѓЃЌМгШыХЈСђЫсМгШШЕФЬѕМўЯТЗЂЩњCa5[PO4]3F+5H2SO4=HFЁќ+3H3PO4+5CaSO4ЃЌЦјЬхAЮЊHFЃЌвКЛЏКѓЃЌHFФмгыЖўбѕЛЏЙшЗДгІЃЌВЛФмдкВЃСЇвЧЦїжаЗДгІЃЌашдкЬижЦШнЦїжагыLiClЗДгІЃЛЗњСзЛвЪЏгыНЙЬПЁЂЪЏгЂЩАдк1500ЁцЗЂЩњ4Ca5(PO4)3F+21SiO2+30C![]() 20CuSiO3+3P4+SiF4Ёќ+30COЁќЃЌАзСзгыТШЦјЕуШМЕФЬѕМўЯТЩњГЩШ§ТШЛЏСзгыЮхТШЛЏСзЕФЛьКЯЮяЃЌдйгыLiClЗДгІЩњГЩLiPF6КЭHClЁЃ
20CuSiO3+3P4+SiF4Ёќ+30COЁќЃЌАзСзгыТШЦјЕуШМЕФЬѕМўЯТЩњГЩШ§ТШЛЏСзгыЮхТШЛЏСзЕФЛьКЯЮяЃЌдйгыLiClЗДгІЩњГЩLiPF6КЭHClЁЃ
(1)ЗлЫщЗњСзЛвЪЏЃЌЕМжТЙЬЬхПХСЃаЁЃЌНгДЅУцЛ§діДѓЃЌЦфФПЕФЮЊдіДѓНгДЅУцЛ§ЃЌМгПьЗДгІЫйТЪЃЛ
(2)ЩњГЩЕФЦјЬхЮЊHFЃЌHFФмгыВЃСЇЛђЬеДЩвЧЦїжаЕФЖўбѕЛЏЙшЗДгІЃЌЙЪашдкЬижЦШнЦїЗДгІЃЛ
(3)ИљОнЗДгІЕФЗНГЬЪНЃЌЛьКЯЮяжаКЌгаCaSO4КЭH3PO4ЃЛ
(4) жЦБИАзСз(P4)жаВњЩњSiF4КЭвЛжжЛЙдадЦјЬхCOЃЌЗДгІЕФЗНГЬЪНЮЊ4Ca5(PO4)3F+21SiO2+30C![]() 20CuSiO3+3P4+SiF4Ёќ+30COЁќЃЛ
20CuSiO3+3P4+SiF4Ёќ+30COЁќЃЛ
(5)ЮВЦјжаPCl5гУзуСПЕФЩеМюШмвКЮќЪеЩњГЩСзЫсФЦКЭТШЛЏФЦЃЌРызгЗНГЬЪНЮЊPCl5+8OH-=PO43-+5Cl-+4H2OЃЛ
(6)LiCl+6HF+PCl5=LiPF6+6HClЃЌ42.5kgLiClЕФЮяжЪЕФСПЮЊ1000molЃЌРэТлЩњГЩ1000molLiPF6ЃЌжЪСПЮЊ152kgЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЉЮяжаМфЬхQЁЂвНгУВФСЯPVAЕФКЯГЩТЗЯпШчЯТЁЃ
вбжЊЃК
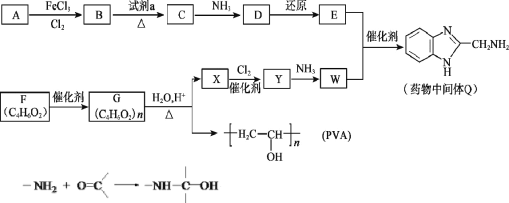
ЃЈ1ЃЉAЕФЗжзгЪНЪЧC6H6ЃЌAЁњBЕФЗДгІРраЭЪЧ_______ЁЃ
ЃЈ2ЃЉBЁњCЪЧЯѕЛЏЗДгІЃЌЪдМСaЪЧ_______ЁЃ
ЃЈ3ЃЉCЁњDЮЊШЁДњЗДгІЃЌЦфЛЏбЇЗНГЬЪНЪЧ_______ЁЃ
ЃЈ4ЃЉFКЌгаЕФЙйФмЭХЪЧ________ЁЃ
ЃЈ5ЃЉFЕФКЌгаЬМЬМЫЋМќКЭѕЅЛљЕФЭЌЗжвьЙЙЬхга_____жжЃЈКЌЫГЗДвьЙЙЬхЃЌВЛКЌFЃЉЃЌЦфжаКЫДХЙВеёЧтЦзга3зщЮќЪеЗхЃЌЧвФмЗЂЩњвјОЕЗДгІЕФНсЙЙМђЪНЪЧ___ЃЎ
ЃЈ6ЃЉGЁњXЕФЛЏбЇЗНГЬЪНЪЧ________ЁЃ
ЃЈ7ЃЉWФмЗЂЩњОлКЯЗДгІЃЌаЮГЩЕФИпЗжзгНсЙЙМђЪНЪЧ________ЁЃ
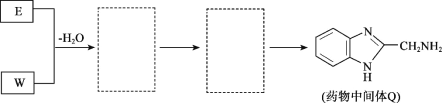
ЃЈ8ЃЉНЋЯТСаE+WЁњQЕФСїГЬЭМВЙГфЭъећЃЈдкащЯпПђФкаДГіЮяжЪЕФНсЙЙМђЪНЃЉЃК_________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЙАЉвЉЮяЕФНсЙЙМђЪНШчЭМЫљЪОЃЌЦфжаWЁЂXЁЂYЁЂZЪЧдзгађЪ§вРДЮдіДѓЕФЖЬжмЦкжїзхдЊЫиЃЌWЁЂYЭЌжїзхЃЌYЁЂZЕФзюЭтВуЕчзгЪ§жЎКЭЪЧXЕФзюЭтВуЕчзгЪ§ЕФ2БЖЁЃЯТСаа№Ъіе§ШЗЕФЪЧ
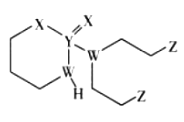
A.дЊЫиЕФЗЧН№ЪєадЃКW>Z>X
B.YЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЪЧЧПЫс
C.WЕФзюМђЕЅЧтЛЏЮягыZЕФЕЅжЪЛьКЯКѓПЩВњЩњАзбЬ
D.YЁЂZаЮГЩЕФЛЏКЯЮяжаЃЌУПИідзгОљТњзу8ЕчзгНсЙЙ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫФЕтЛЏЮ§ЪЧвЛжжГШКьЩЋНсОЇЃЌШлЕуЮЊ144ЃЎ5ЁцЃЌЗаЕуЮЊ364ЁцЃЌВЛШмгкРфЫЎЃЌШмгкДМЁЂБНЁЂТШЗТЕШЃЌгіЫЎвзЫЎНтЃЌГЃгУзїЗжЮіЪдМСКЭгаЛњКЯГЩЪдМСЁЃЪЕбщЪвжЦБИЫФЕтЛЏЮ§ЕФжївЊВНжшШчЯТЃК
ВНжш1ЃКдкИЩдяЕФдВЕзЩеЦПжаМгШыЩйСПЫщЮ§ВКЭЩдЙ§СПЕФI2ЃЌдйМгШы30mLБљДзЫсКЭ30mLДзЫсєћ[(CH3CO)2O]ЁЃЪЕбщзАжУШчЭМЫљЪОЃЌзщзАКУКѓгУУКЦјЕЦМгШШжСЗаЬкдМ1-1ЃЎ5hЃЌжСЗДгІЭъГЩЃЛ
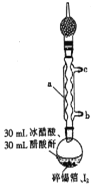
ВНжш2ЃКРфШДНсОЇЃЌЙ§ТЫЕУЕНЫФЕтЛЏЮ§ДжЦЗЃЛ
ВНжш3ЃКДжЦЗжаМгШы30mLТШЗТЃЌЫЎдЁМгШШЛиСїШмНтКѓЃЌГУШШЙ§ТЫЃЛ
ВНжш4ЃКНЋТЫвКЕЙШыеєЗЂУѓжаЃЌжУгкЭЈЗчГїФкЃЌД§ТШЗТШЋВПЛгЗЂКѓЕУЕНЫФЕтЛЏЮ§ОЇЬхЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЭМжавЧЦїaЕФУћГЦЮЊ__________ЃЛРфШДЫЎДгНгПк__________(ЬюЁАbЁБЛђЁАcЁБ)НјШыЁЃ
ЃЈ2ЃЉвЧЦїaЩЯСЌНгзАгаЮоЫЎCaCl2ЕФИЩдяЙмЕФФПЕФЪЧ__________ЃЛЮ§ВашМєЫщЕФФПЕФЪЧ__________ЃЛМгШыДзЫсєћЕФФПЕФЪЧ__________ЁЃ
ЃЈ3ЃЉЩеЦПжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________ЃЛЕЅжЪЕташЙ§СПЕФжївЊФПЕФЪЧ__________ЁЃ
ЃЈ4ЃЉЗДгІвбЕНжеЕуЕФЯжЯѓЪЧ__________ЁЃ
ЃЈ5ЃЉВНжш3КЭВНжш4ЕФФПЕФЪЧ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2008АТдЫМЊЯщЮяИЃЭоЃЌЦфЭтВФЮЊДПбђУЋЯпЃЌФкГфЮяЮЊЮоЖОЕФОлѕЅЯЫЮЌ(ШчЭМ)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A.бђУЋгыОлѕЅЯЫЮЌЕФЛЏбЇГЩЗжЯрЭЌ
B.ОлѕЅЯЫЮЌКЭбђУЋвЛЖЈЬѕМўЯТОљФмЫЎНт
C.ИУОлѕЅЯЫЮЌЕФЕЅЬхЮЊЖдБНЖўМзЫсКЭввДМ
D.ОлѕЅЯЫЮЌЪєгкДПОЛЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввЫсЪЧЩњЛюжаЕФвЛжжГЃМћгаЛњЮяЃЌЫќЕФЗжзгНсЙЙФЃаЭШчЭМЫљЪОЁЃ

ЃЈ1ЃЉаДГіввЫсЕФЗжзгЪН _________ЃЌНсЙЙЪН ____________ввЫсжаЙйФмЭХЕФУћГЦ____________ЁЃ
ЃЈ2ЃЉввЫсгы![]() ШмвКЗДгІВњЩњЕФЦјЬхЪЧ__________ЃЈЬюЗжзгЪНЃЉЁЃ
ШмвКЗДгІВњЩњЕФЦјЬхЪЧ__________ЃЈЬюЗжзгЪНЃЉЁЃ
ЃЈ3ЃЉвЛЖЈЬѕМўЯТЃЌввЫсФмгыввДМЗЂЩњЗДгІГЩвЛжжОпгаЯуЮЖЕФгЭзДвКЬхЃЌЧыаДГіЗДгІЕФЛЏбЇЗНГЬЪНЃК_______________ЁЃИУЗДгІЕФРраЭЪЧ________ЗДгІЁЃ
ЃЈ4ЃЉЧыЩшМЦЪЕбщжЄУїввЫсЕФЫсадЧПгкБНЗгЃЈаДГіВйзїМАЯжЯѓЃЉ____
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбѕЛЏбЧЭ(Cu2O)ПЩгУгкЬеДЩЁЂЙЬЬхећСїЦїЃЌПЩгУЯТСаЗДгІжЦБИЃК2(CuSO4H2O)![]() Cu2O+SO2Ёќ+SO3Ёќ+O2Ёќ+10H2OЁЃЛиД№ЯТСаЮЪЬтЃК
Cu2O+SO2Ёќ+SO3Ёќ+O2Ёќ+10H2OЁЃЛиД№ЯТСаЮЪЬтЃК
(1)Cu2OжаЛљЬЌЭЕФРызгЕФМлВуЕчзгХХВМЭМЮЊ________________ЁЃЩЯЪіЗДгІжаЃЌЕчИКадзюДѓЕФдЊЫиЪЧ________________ЃЈЬюдЊЫиЗћКХ)
(2)дЊЫиCuКЭNiЯрСкЃЌЦфЕквЛЁЂЖўЕчРыФмЪ§ОнШчБэЫљЪОЃК
I1/(kJ/mol) | I2/(kJ/mol) | |
Ni | 737.1 | 1753.0 |
Cu | 745.5 | 1957.9 |
ЭЕФЕквЛЁЂЖўЕчРыФмЖМБШФјЖдгІЕФИпЃЌЦфдвђГ§СЫЭЕФКЫЕчКЩЪ§БШЖрЃЌЖдЭтЕчзгЕФЮќЭтСІДѓЭтЃЌЛЙгавЛИідвђЪЧ________ЁЃ
(3)вбжЊH2SO4ЕФНсЙЙЪНШчЭМЫљЪО,ЩЯЪіЗДгІжаЃК

ЂйдкЩЯЪіВњЮяжаЃЌVSEPRФЃаЭгыSO42-ЯрЭЌЕФЪЧ________(ЬюЛЏбЇЪН)
ЂкSO3ЗжзгЕФСЂЬхЙЙаЭЪЧ________________ЃЌаДГівЛжжгыSO3ЛЅЮЊЕШЕчзгЬхЕФРызгЃК________ЃЈЬюРызгЗћКХ)
(4)Cu2+ЁЂCu+гыCN-ЁЂOH-ЁЂNH3ЁЂH2OЕШзщГЩЖржжХфРызгЁЃ[Cu(NH3)4]2+жаЕФCu2+ХфЮЛЪ§ЮЊ________ЁЃ
(5)ЭдЊЫиКЭбѕдЊзщГЩвЛжжОЇЬхMЃЌMЕФОЇАћШчЭМЫљЪОЁЃ

вбжЊЃКNAЪЧАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌMОЇЬхУмЖШЮЊdgcm-3ЁЃMЕФОЇАћжаCu+ЁЂCl-ИіЪ§БШЮЊ________ЃЌОЇАћВЮЪ§ЮЊ________pm(гУКЌdКЭNAЕФДњЪ§ЪНБэЪО)ЁЃ(гУКЌdКЭNAЕФДњЪ§ЪНБэЪО)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУШчЭМзАжУжЦШЁввЫсввѕЅЁЃ
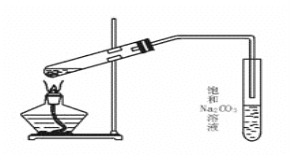
ЃЈ1ЃЉМгШШЧАЃЌДѓЪдЙмжаМгШыМИСЃЫщДЩЦЌЕФзїгУЪЧ___ЃЌЕМЦјЙмВЛФмВхШыБЅКЭNa2CO3ШмвКжаЪЧЮЊСЫ___ЁЃ
ЃЈ2ЃЉБЅКЭNa2CO3ШмвКЕФзїгУЪЧ___ЁЂ___ЁЂ___ЁЃ
ЃЈ3ЃЉЪЕбщЪвЩњГЩЕФввЫсввѕЅЃЌЦфУмЖШБШЫЎ___(ЬюЁАДѓЁБЛђЁАаЁЁБ)ЃЌга___ЦјЮЖЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋEКЭFМгШыУмБеШнЦїжа,дквЛЖЈЬѕМўЯТЗЂЩњЗДгІЃКE(g)ЃЋF(s)![]() 2G(g)ЁЃКіТдЙЬЬхЬхЛ§ЃЌЦНКтЪБGЕФЬхЛ§ЗжЪ§(%)ЫцЮТЖШКЭбЙЧПЕФБфЛЏШчЯТБэЫљЪОЁЃ
2G(g)ЁЃКіТдЙЬЬхЬхЛ§ЃЌЦНКтЪБGЕФЬхЛ§ЗжЪ§(%)ЫцЮТЖШКЭбЙЧПЕФБфЛЏШчЯТБэЫљЪОЁЃ
бЙЧП/MPa ЬхЛ§ЗжЪ§/% ЮТЖШ/Ёц | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
ЂйbЃМf Ђк915ЁцЁЂ2.0MPaЪБEЕФзЊЛЏТЪЮЊ60%ЁЁЂлИУЗДгІЕФІЄSЃО0 ЂмK(1000Ёц)ЃОK(810Ёц)
ЩЯЪіЂйЁЋЂмжае§ШЗЕФга( )
A.4ИіB.3ИіC.2ИіD.1Иі
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com