
【题目】乙酸是生活中的一种常见有机物,它的分子结构模型如图所示。

(1)写出乙酸的分子式 _________,结构式 ____________乙酸中官能团的名称____________。
(2)乙酸与![]() 溶液反应产生的气体是__________(填分子式)。
溶液反应产生的气体是__________(填分子式)。
(3)一定条件下,乙酸能与乙醇发生反应成一种具有香味的油状液体,请写出反应的化学方程式:_______________。该反应的类型是________反应。
(4)请设计实验证明乙酸的酸性强于苯酚(写出操作及现象)____
【答案】C2H4O2 CH3COOH 羧基 CO2 ![]() 酯化(或取代) 将乙酸加入苯酚钠溶液中,再滴加氯化铁溶液,若溶液呈紫色,则乙酸酸性强于苯酚。
酯化(或取代) 将乙酸加入苯酚钠溶液中,再滴加氯化铁溶液,若溶液呈紫色,则乙酸酸性强于苯酚。
【解析】
(1)乙酸的分子式C2H4O2, 结构式为CH3COOH, 官能团的名称为羧基;
(2)乙酸中含羧基,具有酸性,与Na2CO3溶液反应生成CO2;
(3)乙酸能与乙酸发生反应生成乙酸乙酯,为酯化反应,也属于取代反应;
(4)利用强酸制弱酸原理比较乙酸和苯酚的酸性。
(1)乙酸的分子式C2H4O2,结构式为CH3COOH,官能团的名称为羧基;
(2)乙酸中含羧基,具有酸性,与Na2CO3溶液反应生成二氧化碳,其分子式为CO2;
(3)乙酸能与乙酸发生反应生成乙酸乙酯,该反应为![]() ,为酯化反应(取代反应);
,为酯化反应(取代反应);
(4)利用强酸制弱酸原理比较乙酸和苯酚的酸性,将乙酸加入苯酚钠溶液中,再滴加氯化铁溶液若溶液呈紫色,则含有苯酚,可以证明乙酸与苯酚钠发生反应生成苯酚,乙酸酸性强于苯酚。


科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29。
用元素符号或化学式回答下列问题:
(1)Y在周期表中的位置为__________________。
(2)已知YZ2+与XO2互为等电子体,则1mol YZ2+中含有π键数目为___________。
(3)X、Z与氢元素可形成化合物XH2Z,XH2Z分子中X的杂化方式为_________________。
(4)E原子的核外电子排布式为__________;E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该价态的化学式为____________。
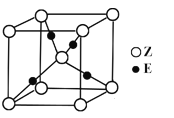
(5)氧元素和钠元素能够形成化合物F,其晶胞结构如图所示(立方体晶胞),晶体的密度为ρg··cm-3,列式计算晶胞的边长为a=______________cm(要求列代数式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物分子的叙述不正确的是( )
A. 乙烯分子中有一个sp2-sp2σ键和一个p-p π键
B. 乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C. 乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D. 苯分子每个碳原子均是sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.35Cl与37Cl互为同素异形体
B.O2与O3互为同位素
C.![]() 与CH3CH2CH2CH3互为同分异构体
与CH3CH2CH2CH3互为同分异构体
D.乙烯与CH3—C≡CH互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟磷酸锂(LiPF6)极易溶于水,可溶于醇等有机溶剂,常作锂离子电池的电解质。某工氟磷灰石[Ca5(PO4)3F]为主要原料,制备六氟磷酸锂的流程如下:
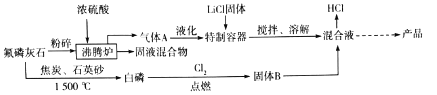
已知:HF的熔点为-83℃,沸点为19.5℃
回答下列问题:
(1)粉碎氟磷灰石的目的是________________________
(2)特制容器不能用玻璃容器,原因是________________(用文字叙述)
(3)沸腾炉中产生固液混合物,该混合物中含有CaSO4和________(除硫酸外)
(4)制备白磷(P4)中产生SiF4和一种还原性气体,制备白磷的化学方程式为________________
(5)尾气中PCl5用足量的烧碱溶液吸收生成两种盐,写出发生反应的离子方程式:________________
(6)如果42.5kgLiCl参与反应,理论上可制备________kgLiPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲胺(CN3NH2)是一种碱性比一水合氨强的一元弱碱。常温下,向体积均为100mL的cmol/L甲胺溶液0.1mol/LNaOH溶液中分别通入HCl气体。lg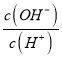 随通入的物质的量的变化如图所示(不考虑溶液体积的变化)。下列有关说法错误的是( )
随通入的物质的量的变化如图所示(不考虑溶液体积的变化)。下列有关说法错误的是( )

A.曲线MOH代表氢氧化钠溶液的变化曲线
B.在a、b、c三点中,c点对应溶液中水的电离程度最大
C.常温下,加水稀释b点溶液,溶液中所有离子浓度都减小
D.c点对应的溶液中,c(Cl-)=c(CH3NH3+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物分子中所有的原子不可能都处于同一平面的是( )
A.C6H5—CH=CH—CHOB.CF2=CF2
C.CH3—O—CH3D.HC≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酰氯(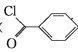 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
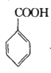 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 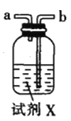 乙.
乙. 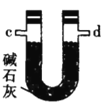 丙.
丙. 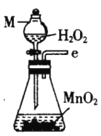 丁.
丁.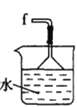 戊.
戊. 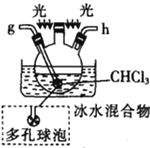
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
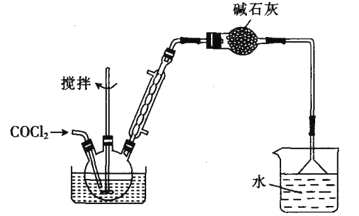
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com