
����Ŀ����֪�װ�(CN3NH2)��һ�ּ��Ա�һˮ�ϰ�ǿ��һԪ��������£��������Ϊ100mL��cmol/L�װ���Һ0.1mol/LNaOH��Һ�зֱ�ͨ��HCl���塣lg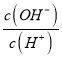 ��ͨ������ʵ����ı仯��ͼ��ʾ(��������Һ����ı仯)�������й�˵���������( )
��ͨ������ʵ����ı仯��ͼ��ʾ(��������Һ����ı仯)�������й�˵���������( )

A.����MOH��������������Һ�ı仯����
B.��a��b��c�����У�c���Ӧ��Һ��ˮ�ĵ���̶����
C.�����£���ˮϡ��b����Һ����Һ����������Ũ�ȶ���С
D.c���Ӧ����Һ�У�c(Cl-)=c(CH3NH3+)��c(H+)=c(OH-)
���𰸡�C
��������
�����£�0.1mol/LNaOH��Һ�У�c(OH-)=0.1mol/L��Kw=10-14����c(H+)=10-13mol/L��lg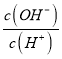 =12��MOH������ΪNaOH����ROHΪCN3NH2��
=12��MOH������ΪNaOH����ROHΪCN3NH2��
A��������֪������MOH����NaOH��Һ�ı仯���ߣ�A˵����ȷ��
B����a��b��c�����У�a��ΪNaOH��Һ��������ǿ������ˮ�ĵ���̶����b��c(OH-)=10-4mol/L��ΪCN3NH2��CN3NH3Cl�Ļ��Һ������ˮ�ĵ�����c��c(H+)= c(OH-)����ˮ�ĵ������Ƴ̶ȼ�������c���Ӧ��Һ��ˮ�ĵ���̶����B˵����ȷ��
C�������£�b��ΪCN3NH2��CN3NH3Cl�Ļ��Һ����Һ�ʼ��ԣ���ˮϡ��b����Һ����Һ��c(OH-)��С���¶Ȳ��䣬��Kw���䣬c(H+)����C˵������
D��c��c(H+)=c(OH-)=10-7mol/L�����ݵ���غ㣬c(CH3NH3+)+c(H+)=c(Cl-)+c(OH-)����c(CH3NH3+)=c(Cl-)����ԶԶ����c(H+)���ʶ�Ӧ����Һ�У�c(Cl-)=c(CH3NH3+)��c(H+)=c(OH-)��D˵����ȷ��
��ΪC��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڷ��Ӿ�����ǣ�������
A. �۵���10.31����Һ̬�����磬ˮ��Һ�ܵ���
B. �۵���1070������̬�����磬����״̬�ܵ��磬������ˮ
C. �۵�3550����������ˮ��������
D. �۵���97.80������������̬�ɵ��磬�ܶ���0.97g��cm��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѳ���ҵ�����еĵ�������(��Ҫ��ָNO��NO2)���Ծ������������ƻ������ǻ�����������Ҫ���⡣
(1)����������NH3��ԭ�����ɽ�NOx��ԭΪN2�����ѳ���
��֪����4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H=-905.9 kJ/mol
4NO(g)+6H2O(g) ��H=-905.9 kJ/mol
��N2(g)+O2(g)![]() 2NO(g) ��H=+180 kJ/mol
2NO(g) ��H=+180 kJ/mol
��H2O(g)![]() H2O(l) ��H=-44 kJ/mol
H2O(l) ��H=-44 kJ/mol
д�������£�NH3��ԭNO��Ӧ���Ȼ�ѧ����ʽ��____________��
(2)��Ư�۾���ҺΪ���ռ�������Ч�ѳ������е�NO��
��Ư�۾���Һ����Ҫ�ɷ���Ca(ClO)2�������չ����У����ĵ�Ca(ClO)2�����յ�NO�����ʵ���֮��Ϊ3��4�����ѳ���NOת��Ϊ____________��
��ijһ��ȤС���о���ͬ�¶�����ͬŨ��Ư�۾���Һ��NO�ѳ��ʵ�Ӱ�죬�����ͼ��ʾ��

ͼ�У�40��60�� NO�ѳ����������ܵ�ԭ��Ϊ____________��60��80�� NO�ѳ����½����ܵ�ԭ��Ϊ____________��
(3)��������(Na2S2O8)����ȥ��NO
��һ����NO�ڼ��Ի����б�Na2S2O8����ΪNaNO2
�ڶ����� NaNO2����������ΪNaNO3����ӦΪNO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O����ͬ�¶��£�ƽ��ʱNO2-���ѳ������������(Na2S2O8)��ʼŨ��(ָ�ڶ�����Ӧ�ij�ʼŨ��)�Ĺ�ϵ��ͼ��ʾ��
NO3-+2SO42-+H2O����ͬ�¶��£�ƽ��ʱNO2-���ѳ������������(Na2S2O8)��ʼŨ��(ָ�ڶ�����Ӧ�ij�ʼŨ��)�Ĺ�ϵ��ͼ��ʾ��
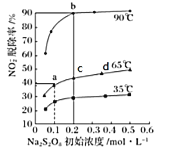
��a��b��c��d�ĵ�ƽ�ⳣ��K�ɴ�С��˳��Ϊ____________��ԭ����____________��
����a��(0.1��40%)ʱ��NO2-�ij�ʼŨ��Ϊa mol��L-1��ƽ��ʱpH=13����65��ʱ���ڶ�����Ӧ��ƽ�ⳣ��K=____________��(�ú�a�Ĵ���ʽ��ʾ)
(4)�������Ͳ��Ϲ���ѳ�NO����ͼ��ʾ��

ij�绯С�齫����A��B��Ƴ����Ե��ط�Ӧ����÷�Ӧ��������ӦΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܡ����Ƚ������仯�����ڿ�ѧ�о���ҵ������Ӧ��ʮ�ֹ㷺���ش��������⣺
��1�������ܡ����Ļ�̬ԭ�Ӻ���δ�ɶԵ�����������_________��
��2��̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ����������Ϊ�����ӣ�̪�ܷ�������������ͨ����λ����ϵĵ�ԭ�ӵı����_______(��1��2��3��4)�����ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ_______(����Ӧ��Ԫ�ط��ű�ʾ)����ԭ�ӵ��ӻ��������Ϊ________��

��3��Fe(CO)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)x����������_______(�������)���������Fe(CO)x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18����x=________��
��4��NiO��FeO�ľ���ṹ�������Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm�����۵�NiO______FeO(����>����<������=��)��ԭ����_________��
��5��NiAs�ľ����ṹ��ͼ��ʾ���������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA�������ܶ�Ϊpg��cm-3����þ����������Ni2+֮��ľ���Ϊ________cm��(д���������ʽ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������е�һ�ֳ����л�����ķ��ӽṹģ����ͼ��ʾ��

��1��д������ķ���ʽ _________���ṹʽ ____________�����й����ŵ�����____________��
��2��������![]() ��Һ��Ӧ������������__________�������ʽ����
��Һ��Ӧ������������__________�������ʽ����
��3��һ�������£����������Ҵ�������Ӧ��һ�־�����ζ����״Һ�壬��д����Ӧ�Ļ�ѧ����ʽ��_______________���÷�Ӧ��������________��Ӧ��
��4�������ʵ��֤�����������ǿ�ڱ��ӣ�д������������____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A��B��C������ס��ҡ����Լ�����D��E��F��G��H������֮����ת����ϵ����ͼ��ʾ��ͼ����Щ��Ӧ��������ͷ�Ӧ������û�б������
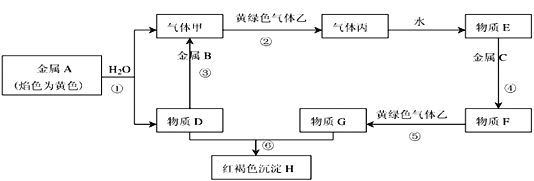
��ش��������⣺
��1��д���������ʵĻ�ѧʽ����_________����_________��
��2��ͼ�з�Ӧ�٢ڢۢܢݢ�������������ԭ��Ӧ���У�_____________________ �������û���Ӧ��Ӧ���У�_______________ ��
��3��д����Ӧ�ݵ����ӷ���ʽ��_____________________��
��4��д����Ӧ�ٵĻ�ѧ����ʽ_______________________________ �����õ���״�� �µļ�����2.24L����μӷ�Ӧ�Ľ���A____________ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.����������Һ�еμ�������ˮ��Ag++2NH3==[Ag(NH3)2]+
B.�Ჴ���ᣨ![]() ����̼��������Һ��Ӧ��
����̼��������Һ��Ӧ��![]() +2HCO3����
+2HCO3����![]() + 2CO2��+2H2O
+ 2CO2��+2H2O
C.��ȩ��������Ӧ��CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO��+NH4++2Ag��+3NH3+H2O
CH3COO��+NH4++2Ag��+3NH3+H2O
D.��������Һ��ͨ������CO2��2C6H5O����CO2��H2O��2C6H5OH��CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
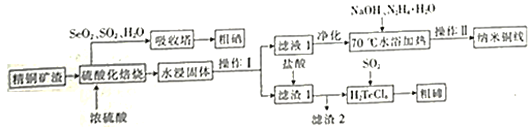
����Ŀ��ȫ����ʮ�컷����ѧ�����2019��8��15��������ٿ�������һ����������Ϊ����ɽ��������Ⱦ������������ͭ�����ھ��ж��صĹ�ѧ����ѧ����ѧ����ѧ���ʶ���Ϊ�Ʊ������Ե���缫���������ϡ�ij��ͭ��������Ҫ�ɷ�ΪCu��Cu2Se��Cu2Te���г�����ͭ������Se�����ڣ�Te���⣬���������������������Ԫ���������������
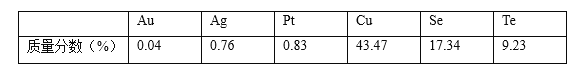
����ͭ�ߵ��Ʊ��������ڵ���Ҫ����������ͼ��
(1)16S��34Se��52TeΪͬ����Ԫ�أ�����52Te��Ԫ�����ڱ��е�λ��Ϊ______��
(2)�������ữ���գ�Cu��Cu2Se��Cu2Teת��ΪCuSO4��SeO2��TeO2������Cu2Te���ữ���յĻ�ѧ����ʽΪ______��
(3)�������ڷ����ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
(4) ��ˮ�������������в��������Ȼ��ƹ��壬�ɼ��ٹ����е�������������Һ1�У���ƽ���ƶ�ԭ���ǶȽ�����ԭ��______��
(5) ��70��ˮԡ������ʱ������Ӧ�����ӷ���ʽΪ______��ˮԡ���ȶ�ʱ�����Һ�г�����״������ȹ��ˣ���ˮϴ������______ϴ�ӡ�������Եõ�����ͭ�ߡ�
(6)Ŀǰ�ڻ��ӱ�Ĥ̫������ҵ��չѸ�٣�����Ϊ�����з�չǰ����̫���ܼ���֮һ�� �о������ڵ͵����ܶȼ��Ե������¡�����TeO32-��Ũ�ȣ����Դٽ�Te�ij�����Te �����ĵ缫��ӦʽΪ______������Na+��______������ʯ ī��������������������缫�ƶ���
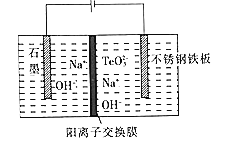
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.������ȼ����Ϊ![]() ������ˮ���Ȼ�ѧ����ʽ
������ˮ���Ȼ�ѧ����ʽ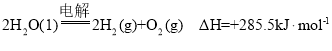
B.�ܱ������У�![]() �����
�����![]() ���ۻ�ϼ�������������
���ۻ�ϼ�������������![]() ʱ���ų�
ʱ���ų�![]() ������
������![]()
C.500�桢![]() �£���
�£���![]() ��
��![]() �����ܱյ������г�ַ�Ӧ����
�����ܱյ������г�ַ�Ӧ����![]() ������
������![]() �����Ȼ�ѧ����ʽ
�����Ȼ�ѧ����ʽ![]()
D.��ͬ�����£���������ͬ�ĺ����ܱ������У�![]() ��
��![]() ��Ӧ�ų���������
��Ӧ�ų���������![]() ��
��![]() ��Ӧ�ų�������һ����
��Ӧ�ų�������һ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com