
����Ŀ��ȫ����ʮ�컷����ѧ�����2019��8��15��������ٿ�������һ����������Ϊ����ɽ��������Ⱦ������������ͭ�����ھ��ж��صĹ�ѧ����ѧ����ѧ����ѧ���ʶ���Ϊ�Ʊ������Ե���缫���������ϡ�ij��ͭ��������Ҫ�ɷ�ΪCu��Cu2Se��Cu2Te���г�����ͭ������Se�����ڣ�Te���⣬���������������������Ԫ���������������
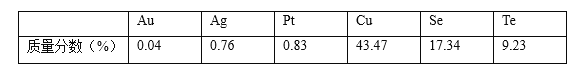
����ͭ�ߵ��Ʊ��������ڵ���Ҫ����������ͼ��
(1)16S��34Se��52TeΪͬ����Ԫ�أ�����52Te��Ԫ�����ڱ��е�λ��Ϊ______��
(2)�������ữ���գ�Cu��Cu2Se��Cu2Teת��ΪCuSO4��SeO2��TeO2������Cu2Te���ữ���յĻ�ѧ����ʽΪ______��
(3)�������ڷ����ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
(4) ��ˮ�������������в��������Ȼ��ƹ��壬�ɼ��ٹ����е�������������Һ1�У���ƽ���ƶ�ԭ���ǶȽ�����ԭ��______��
(5) ��70��ˮԡ������ʱ������Ӧ�����ӷ���ʽΪ______��ˮԡ���ȶ�ʱ�����Һ�г�����״������ȹ��ˣ���ˮϴ������______ϴ�ӡ�������Եõ�����ͭ�ߡ�
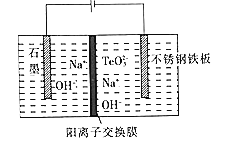
(6)Ŀǰ�ڻ��ӱ�Ĥ̫������ҵ��չѸ�٣�����Ϊ�����з�չǰ����̫���ܼ���֮һ�� �о������ڵ͵����ܶȼ��Ե������¡�����TeO32-��Ũ�ȣ����Դٽ�Te�ij�����Te �����ĵ缫��ӦʽΪ______������Na+��______������ʯ ī��������������������缫�ƶ���
���𰸡�����������A�� Cu2Te+6H2SO4(Ũ)![]() 2CuSO4+TeO2+4SO2��+6H2O 1:2 ���ڴ���ƽ�⣺Ag2SO4(s)
2CuSO4+TeO2+4SO2��+6H2O 1:2 ���ڴ���ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���� 2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O) ��ˮ�Ҵ� TeO32-+4e-+3H2O==Te+6OH- ���������
2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���� 2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O) ��ˮ�Ҵ� TeO32-+4e-+3H2O==Te+6OH- ���������
��������
(1) 52Te��16S��34Seͬ���壬����Ӳ���Ϊ5������������Ϊ6���ɴ˿�ȷ������Ԫ�����ڱ��е�λ�á�
(2)Cu2Te�������ữ���գ�ת��ΪCuSO4��TeO2�������ᱻ��ԭΪSO2�ȡ�
(3)�������ڷ���SeO2��SO2��H2O��������ԭ��Ӧ��SeO2����������ת��ΪSe��SO2����ԭ����ת��ΪH2SO4���ɴ˿�����������뻹ԭ�������ʵ���֮�ȡ�
(4) ��ˮ�������������д�������ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)������AgCl���ɼ��ٹ����е�������������Һ1�С�
2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)������AgCl���ɼ��ٹ����е�������������Һ1�С�
(5) ��70��ˮԡ������ʱ,CuSO4��NaOH��N2H4H2O����������ԭ��Ӧ������Cu�ȡ�ϴ����״������Ա�õ�����ͭ�ߣ�����ʱ��Ӧע���ֹͭ��������
(6)����TeO32-��Ũ�ȣ����Դٽ�Te�ij�����Te ����ʱ����TeO32-ת��ΪTe���ڵ����У��������������ƶ����Ӷ�ȷ��Na+�ƶ��ķ���
(1) 52Te��16S��34Seͬ���壬����Ӳ���Ϊ5������������Ϊ6���Ӷ�ȷ��52Teλ�ڵ���������A�塣��Ϊ������������A�壻
(2)Cu2Te�������ữ���գ�ת��ΪCuSO4��TeO2�������ᱻ��ԭΪSO2�ȣ��Ӷ��ó���Ӧ�Ļ�ѧ����ʽΪCu2Te+6H2SO4(Ũ)![]() 2CuSO4+TeO2+4SO2��+6H2O����Ϊ��Cu2Te+6H2SO4(Ũ)
2CuSO4+TeO2+4SO2��+6H2O����Ϊ��Cu2Te+6H2SO4(Ũ)![]() 2CuSO4+TeO2+4SO2��+6H2O��
2CuSO4+TeO2+4SO2��+6H2O��
(3)�������ڷ���SeO2��SO2��H2O��������ԭ��Ӧ��SeO2����������ת��ΪSe��SO2����ԭ����ת��ΪH2SO4��������Ӧ�Ļ�ѧ����ʽΪSeO2+2SO2+2H2O==Se+2H2SO4���ɴ˵ó��������뻹ԭ�������ʵ���֮��Ϊ1:2����Ϊ��1:2��
(4) ��ˮ�������������д�������ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)�����ɸ����ܵ�AgCl���ɼ��ٹ����е�������������Һ1�С���Ϊ�����ڴ���ƽ�⣺Ag2SO4(s)
2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)�����ɸ����ܵ�AgCl���ɼ��ٹ����е�������������Һ1�С���Ϊ�����ڴ���ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��span>Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���У�
2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��span>Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���У�
(5) ��70��ˮԡ������ʱ,CuSO4��NaOH��N2H4H2O����������ԭ��Ӧ������Cu�ȣ�������Ӧ�����ӷ���ʽΪ2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O)��ϴ����״������Ա�õ�����ͭ�ߣ�����ʱ��Ϊ��ֹͭ��������Ӧʹ���Ҵ�ϴ�ӡ���Ϊ��2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O)���Ҵ���
(6) Te ����ʱ����TeO32-ת��ΪTe�����ڼ��Ի����У��缫��ӦʽΪTeO32-+4e-+3H2O==Te+6OH-����ͼ�п��Կ��������Դ����������ʯīΪ���������Դ���������IJ��������Ϊ���������ʱ����Һ�е��������������ƶ�����Na+����������塣��Ϊ��TeO32-+4e-+3H2O==Te+6OH-����������塣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̵���ģ������̵������ش�������о����⡣����������ѧ����ƽ�����Ŷ���ƺϳ���һ�������ڱ����������˫��������������˫�����ӷ�����ѧ�̵��µĹ��ܷ���ģ�͡���ͼ���������IJ�ͼ������˵���������
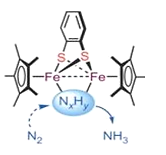
A.�������ܸı䷴Ӧ���ʱ�
B.�������ܸı䷴Ӧ�Ļ��
C.ͼ�з�Ӧ�м���NXHY��ֵX<3
D.ͼʾ���������а�����λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�װ�(CN3NH2)��һ�ּ��Ա�һˮ�ϰ�ǿ��һԪ��������£��������Ϊ100mL��cmol/L�װ���Һ0.1mol/LNaOH��Һ�зֱ�ͨ��HCl���塣lg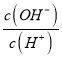 ��ͨ������ʵ����ı仯��ͼ��ʾ(��������Һ����ı仯)�������й�˵���������( )
��ͨ������ʵ����ı仯��ͼ��ʾ(��������Һ����ı仯)�������й�˵���������( )

A.����MOH��������������Һ�ı仯����
B.��a��b��c�����У�c���Ӧ��Һ��ˮ�ĵ���̶����
C.�����£���ˮϡ��b����Һ����Һ����������Ũ�ȶ���С
D.c���Ӧ����Һ�У�c(Cl-)=c(CH3NH3+)��c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������Ҵ���Ũ������ȷ�Ӧ��ȡ��ϩ����ش��������⣺
��1��д��ʵ��������ϩ�Ļ�ѧ��Ӧ����ʽ��___���÷�Ӧ��Ũ����������ǣ�___��___��
��2�������������ʵ����ȷ�������������������ϩ�Ͷ��������Իش��������⣺
��ͼ��A��B��C��D4��װ�ÿ�ʢ�ŵ��Լ���A___��B___��C___��D__���������й��Լ�����������ո��ڣ���
��1��Ʒ����Һ ��2��NaOH��Һ ��3��KMnO4��Һ
����˵����������������ڵ�������___��
��ʹ��װ��B��Ŀ����___��
��ʹ��װ��C��Ŀ����___��
����֤��������ϩ��������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ����һ�������������仯�������������й㷺Ӧ�á�
(1)��̬Fe3+�ĵ����Ų�ʽΪ_________________��
(2)ʵ������KSCN��Һ������(![]() )����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
)����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
(3)FeCl3���۵�Ϊ306�棬�е�Ϊ315�档FeCl3�ľ���������________��FeSO4������������SO42-�����幹����__________��
(4)�ʻ���[Fe(CO)5]���������������Ϳ������ȡ�1 mol Fe(CO)5�����к�________mol��������CO��Ϊ�ȵ������������__________(�ѧʽ��дһ��)��
(5)����������ľ���ṹʾ��ͼ��ͼ1��ʾ���þ�������������������֮��Ϊ_____��

(6)������������ľ�����ͼ2��ʾ����֪����������������ܶ�Ϊ��g��cm-3��NA���������ӵ�������ֵ���ڸþ����У���Fe2+�����ҵȾ����Fe2+��ĿΪ_____��Fe2+��O2-����̺˼��Ϊ___________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����ʵ�����о��ܼ������������������Ʒ�Ӧ��Ӱ�죬��ش��������⣺
ʵ��1����������������NaOHˮ��Һ��ϣ����ȡ�
(1)����Br����ȡ��Ӧ������___��Һ��(����������������)�������м���________(���Լ�)���۲쵽�е���ɫ�������ɡ�
(2)�����Ҵ�����__________________(�������)���������������Ҵ����ɴ˿�֪�÷�Ӧ����Ϊ_____________��
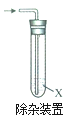
ʵ��2����������������NaOH�Ҵ���Һ��ϣ����ȡ�
(3)������ϩ������Ӧ����������ͨ���Ҳ��Թ��У��۲쵽��Һ��ɫ���Լ�X��_____________
(4)д����������NaOH�Ҵ���Һ��Ӧ�Ļ�ѧ����ʽ_________________
ʵ����ۣ�
(5)��ʵ��1��2�ó��Ľ�����_______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G�Ǽ��������ӵ����ģ��(��ͼ)���ݴ˻ش��������⣺

��1����������������ȼ�պ�������ߵ���(���Ӧ��ĸ)__��
��2������ͬϵ�����(���Ӧ��ĸ)___��
��3������ԭ�Ӷ���ͬһƽ���ϵ���(���Ӧ��ĸ)___��
��4��һ±��������������(���Ӧ��ĸ)___��
��5��ʵ������D�Ļ�ѧ����ʽ___��
��6��д��G�ϳ�����ըҩ(TNT)�Ļ�ѧ����ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������²���ɴ�![]() �ϳ�
�ϳ� ![]() (�����Լ��ͷ�Ӧ������ȥ)��
(�����Լ��ͷ�Ӧ������ȥ)��
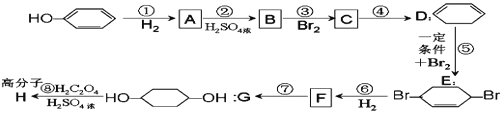
��ش��������⣺
(1)A������Ϊ__________��
(2)�ֱ�д�� B��F �Ľṹ��ʽ��B_____��F_____��
(3)��Ӧ�١�����������ȥ��Ӧ����_____�����ڼӳɷ�Ӧ����_____(�����)��
(4)���ݷ�Ӧ![]() +Br2
+Br2![]() ��д����ͬ��������CH2=CH��CH=CH2 ������ʵ���Br2��Ӧ�Ļ�ѧ����ʽ��__________________��
��д����ͬ��������CH2=CH��CH=CH2 ������ʵ���Br2��Ӧ�Ļ�ѧ����ʽ��__________________��
(5)д���ڢܲ��Ļ�ѧ����ʽ_______________��
(6)�����л�������У��ں˴Ź�������ͼ���ܸ������ַ�(�ź�)��ǿ��֮��Ϊ 1��1��2 ����_______________��
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������Ӧ�Ļ�ѧ����ʽ��![]() ��δ��ƽ����Ӧ������ȥ��������A��B�����ʵ���֮��Ϊ1��4.��ش�
��δ��ƽ����Ӧ������ȥ��������A��B�����ʵ���֮��Ϊ1��4.��ش�
��1����Y�ǻ���ɫ���壬��Y�ĵ���ʽ��____���÷�Ӧ�����ӷ���ʽ��___________��
��2����AΪ�ǽ������ʣ���������ԭ�Ӻ��������������Ǵ�����������2����B����ҺΪijŨ�ᣬ��Ӧ���������뻹ԭ�������ʵ���֮����_____��
��3����AΪ�������ʣ�������A��B��Ũ��Һ�����ۻ�������A������X��Һ�С�
��AԪ�������ڱ��е�λ����______�����������ں��壩��Y�Ļ�ѧʽ��_________��
�ں�![]() ����Һ�ܽ���һ����A������Һ�����ֽ��������ӵ����ʵ���ǡ����ȣ���ԭ��X��__
����Һ�ܽ���һ����A������Һ�����ֽ��������ӵ����ʵ���ǡ����ȣ���ԭ��X��__![]() ��
��
��4����A��B��X��Y��Ϊ�������A��Һ�м��������ữ��![]() ��Һ��������ɫ������B����ɫΪ��ɫ����A��B�����ʵ���֮��1��4ǡ�÷�Ӧ����Ӧ�����ӷ���ʽΪ___________��
��Һ��������ɫ������B����ɫΪ��ɫ����A��B�����ʵ���֮��1��4ǡ�÷�Ӧ����Ӧ�����ӷ���ʽΪ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com