
【题目】中学常见反应的化学方程式是![]() (未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是____,该反应的离子方程式是___________。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是_____。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是_________。
②含![]() 的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是__
的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是__![]() 。
。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的![]() 溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,则反应的离子方程式为___________。
溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,则反应的离子方程式为___________。
【答案】![]()
![]() 4∶1 第4周期Ⅷ族
4∶1 第4周期Ⅷ族 ![]()
![]()
![]()
【解析】
中学常见反应的化学方程式是![]() (未配平,反应条件略去),其中A、B的物质的量之比为1∶4,请回答:
(未配平,反应条件略去),其中A、B的物质的量之比为1∶4,请回答:
⑴若Y是黄绿色气体,Y为Cl2。
⑵若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,A为C,B的溶液为某浓酸,B为浓硝酸。
⑶若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,A为铁,B为浓硝酸。
⑷若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的![]() 溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,A为AlCl3、B为NaOH。
溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,A为AlCl3、B为NaOH。
中学常见反应的化学方程式是![]() (未配平,反应条件略去),其中A、B的物质的量之比为1∶4。
(未配平,反应条件略去),其中A、B的物质的量之比为1∶4。
⑴若Y是黄绿色气体,Y为Cl2,则Y的电子式是![]() ,该反应的离子方程式是
,该反应的离子方程式是![]() ;故答案为:
;故答案为:![]() ;
;![]() 。
。
⑵若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,A为C,B的溶液为某浓酸,B为浓硝酸,碳和浓硝酸反应方程式为:C + 4HNO3(浓) ![]() CO2↑+ 4NO2↑+ 2H2O,氧化剂为HNO3,还原剂为C,则反应中氧化剂与还原剂的物质的量之比是4:1;故答案为:4:1。
CO2↑+ 4NO2↑+ 2H2O,氧化剂为HNO3,还原剂为C,则反应中氧化剂与还原剂的物质的量之比是4:1;故答案为:4:1。
⑶若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,A为铁,B为浓硝酸。
①Fe+ 4HNO3(稀) ![]() Fe(NO3)3↑+ NO↑+ 2H2O A元素在周期表中的位置是第4周期Ⅷ族;Y的化学式是NO;故答案为:第4周期Ⅷ族;NO。
Fe(NO3)3↑+ NO↑+ 2H2O A元素在周期表中的位置是第4周期Ⅷ族;Y的化学式是NO;故答案为:第4周期Ⅷ族;NO。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,根据离子方程式2Fe3+ + Fe = 3Fe2+,设被还原的X为bmol,则有a – b = ![]() ,b=0.4a;故答案为:0.4a。
,b=0.4a;故答案为:0.4a。
⑷⑷若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的![]() 溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,A为AlCl3、B为NaOH,
溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,A为AlCl3、B为NaOH,
则反应的离子方程式为![]() ;故答案为:
;故答案为:![]() 。
。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
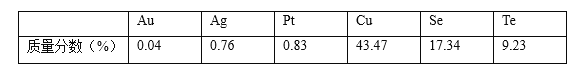
【题目】全国第十届环境化学大会于2019年8月15日在天津召开,其中一项会议的议题为“矿山环境与污染控制“。纳米铜线由于具有独特的光学、电学、力学和热学性质而成为制备透明柔性导电电极的优良材料。某精铜矿渣(主要成分为Cu、Cu2Se和Cu2Te)中除含有铜、硒(Se)、碲(Te)外,还含有少量贵金属,部分元素质量分数如表:
纳米铜线的制备与硒、碲的主要回收流程如图:
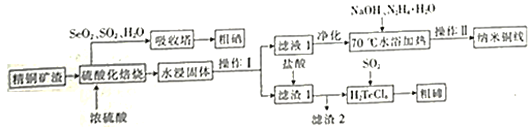
(1)16S、34Se、52Te为同主族元素,其中52Te在元素周期表中的位置为______。
(2)经过硫酸化焙烧,Cu、Cu2Se和Cu2Te转化为CuSO4,SeO2和TeO2.其中Cu2Te硫酸化培烧的化学方程式为______。
(3)吸收塔内发生的反应中氧化剂与还原剂的物质的量之比为______。
(4) “水浸固体”过程中补充少量氯化钠固体,可减少固体中的硫酸银进人滤液1中,从平衡移动原理角度解释其原因:______。
(5) “70℃水浴加热”时发生反应的离子方程式为______。水浴加热段时间后,溶液中出现线状悬浮物,先过滤,后水洗,再用______洗涤、干燥,可以得到纳米铜线。
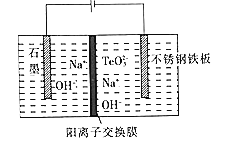
(6)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。 研究发现在低电流密度碱性的条件下。增加TeO32-的浓度,可以促进Te的沉积。Te 沉积的电极反应式为______,其中Na+向______(填“石 墨”或“不锈钢铁板“)电极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氢气的燃烧热为![]() ,则电解水的热化学方程式
,则电解水的热化学方程式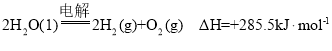
B.密闭容器中,![]() 硫粉与
硫粉与![]() 铁粉混合加热生成硫化亚铁
铁粉混合加热生成硫化亚铁![]() 时,放出
时,放出![]() 热量。
热量。![]()
C.500℃、![]() 下,将
下,将![]() 和
和![]() 置于密闭的容器中充分反应生成
置于密闭的容器中充分反应生成![]() ,放热
,放热![]() ,其热化学方程式
,其热化学方程式![]()
D.相同条件下,在两个相同的恒容密闭容器中,![]() 和
和![]() 反应放出的热量与
反应放出的热量与![]() 和
和![]() 反应放出的热量一样多
反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用来监测空气中NO的含量,下列说法正确的是( )
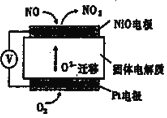
A.电子由Pt电极流出,经外电路流向NiO电极
B.Pt电极上发生的是氧化反应
C.NiO电极的电极反应式为NO+O2--2e-=NO2
D.每流经1 m3空气(假设NO被完全吸收),转移电子的物质的量为2×10-7mol,则该空气中NO的含量约为3×10-2mg/m3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是
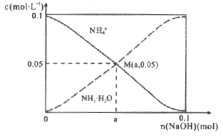
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制备1,2-二溴乙烷的反应原理如下:①乙醇在浓硫酸的存在下制取乙烯、②乙烯与溴反应制得1,2-二溴乙烷。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:

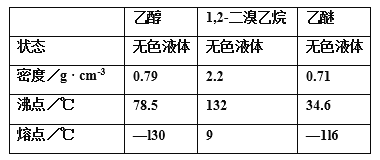
回答下列问题:
(1)写出乙醇在浓硫酸的存在下制取乙烯的化学方程式______________;浓硫酸所起的作用是___________ 。
(2)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______;(填正确选项前的字母)
a.引发反应 b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(3)反应一段时间后三颈烧瓶A中的液体混合物会逐渐变黑,此时会发生另一个副反应生成其他酸性杂质气体,该反应的化学方程式为_________ 。
(4)在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是________________;
(6)若产物中有少量副产物乙醚,可用_____________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )

A.电解开始时阴极有H2放出
B.电解开始时阳极上发生:Cu2++2e-Cu
C.整个电解过程中,SO42-不参与电极反应
D.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com