
【题目】下列说法正确的是( )
A.氢气的燃烧热为![]() ,则电解水的热化学方程式
,则电解水的热化学方程式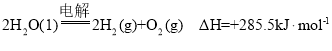
B.密闭容器中,![]() 硫粉与
硫粉与![]() 铁粉混合加热生成硫化亚铁
铁粉混合加热生成硫化亚铁![]() 时,放出
时,放出![]() 热量。
热量。![]()
C.500℃、![]() 下,将
下,将![]() 和
和![]() 置于密闭的容器中充分反应生成
置于密闭的容器中充分反应生成![]() ,放热
,放热![]() ,其热化学方程式
,其热化学方程式![]()
D.相同条件下,在两个相同的恒容密闭容器中,![]() 和
和![]() 反应放出的热量与
反应放出的热量与![]() 和
和![]() 反应放出的热量一样多
反应放出的热量一样多
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】已知甲胺(CN3NH2)是一种碱性比一水合氨强的一元弱碱。常温下,向体积均为100mL的cmol/L甲胺溶液0.1mol/LNaOH溶液中分别通入HCl气体。lg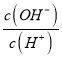 随通入的物质的量的变化如图所示(不考虑溶液体积的变化)。下列有关说法错误的是( )
随通入的物质的量的变化如图所示(不考虑溶液体积的变化)。下列有关说法错误的是( )

A.曲线MOH代表氢氧化钠溶液的变化曲线
B.在a、b、c三点中,c点对应溶液中水的电离程度最大
C.常温下,加水稀释b点溶液,溶液中所有离子浓度都减小
D.c点对应的溶液中,c(Cl-)=c(CH3NH3+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:

(1)等质量的上述烃燃烧耗氧量最高的是(填对应字母)__;
(2)属于同系物的是(填对应字母)___;
(3)所有原子都在同一平面上的是(填对应字母)___;
(4)一卤代物总类最多的是(填对应字母)___;
(5)实验室制D的化学方程式___;
(6)写出G合成烈性炸药(TNT)的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成 ![]() (部分试剂和反应条件已去).
(部分试剂和反应条件已去).
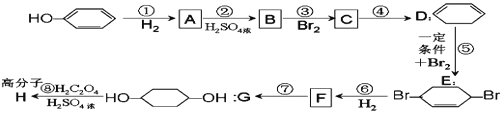
请回答下列问题:
(1)A的名称为__________。
(2)分别写出 B、F 的结构简式:B_____、F_____。
(3)反应①~⑦中属于消去反应的是_____,属于加成反应的是_____(填代号)。
(4)根据反应![]() +Br2
+Br2![]() ,写出在同样条件下CH2=CH—CH=CH2 与等物质的量Br2反应的化学方程式:__________________。
,写出在同样条件下CH2=CH—CH=CH2 与等物质的量Br2反应的化学方程式:__________________。
(5)写出第④步的化学方程式_______________。
(6)下列有机物分子中,在核磁共振氢谱图中能给出三种峰(信号)且强度之比为 1∶1∶2 的是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
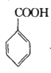
【题目】苯甲酰氯(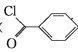 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 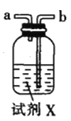 乙.
乙. 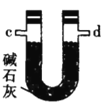 丙.
丙. 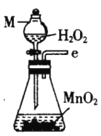 丁.
丁.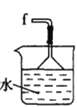 戊.
戊. 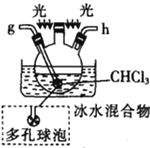
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
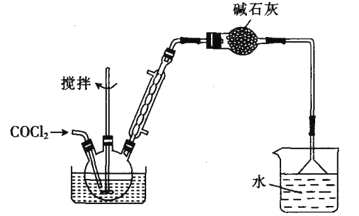
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把锌片和铁片放在盛有稀食盐水和K3[Fe(CN)6]试液混合溶液的培养皿中(如图所示平面图),经过一段时间后,下列说法中正确的是

A. Ⅰ附近溶液pH降低
B. Ⅳ附近很快生成铁锈
C. Ⅲ附近产生黄绿色气体
D. Ⅱ附近很快出现蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)水存在如下平衡:H2O![]() H++OH-,保持温度不变向水中加入NaHSO4固体,水的电离平衡向___(填“左”或“右”)移动,,所得溶液显__性,Kw__(填“增大”“减小”或“不变”)。
H++OH-,保持温度不变向水中加入NaHSO4固体,水的电离平衡向___(填“左”或“右”)移动,,所得溶液显__性,Kw__(填“增大”“减小”或“不变”)。
(2)常温下,0.1mol·L-1CH3COONa溶液的pH为9,则由水电离出的c(H+)=___。
(3)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m___n(填“>”“<”或“=”)。
(4)已知HA和HB均为弱酸,且酸性HA>HB,则等浓度的NaA和NaB溶液中,PH大小关系为NaA___NaB(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式是![]() (未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是____,该反应的离子方程式是___________。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是_____。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是_________。
②含![]() 的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是__
的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是__![]() 。
。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的![]() 溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,则反应的离子方程式为___________。
溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,则反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com