
【题目】按要求填空
(1)水存在如下平衡:H2O![]() H++OH-,保持温度不变向水中加入NaHSO4固体,水的电离平衡向___(填“左”或“右”)移动,,所得溶液显__性,Kw__(填“增大”“减小”或“不变”)。
H++OH-,保持温度不变向水中加入NaHSO4固体,水的电离平衡向___(填“左”或“右”)移动,,所得溶液显__性,Kw__(填“增大”“减小”或“不变”)。
(2)常温下,0.1mol·L-1CH3COONa溶液的pH为9,则由水电离出的c(H+)=___。
(3)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m___n(填“>”“<”或“=”)。
(4)已知HA和HB均为弱酸,且酸性HA>HB,则等浓度的NaA和NaB溶液中,PH大小关系为NaA___NaB(填“>”“<”或“=”)。
【答案】左 酸 不变 1×10-5 < <
【解析】
(1)硫酸氢钠溶液中完全电离,电离方程式NaHSO4=Na++H++SO42-分析;
(2)能水解的盐溶液促进了水的电离,碱溶液中的氢离子是水电离的,CH3COONa溶液中的氢氧根离子是水电离的;
(3)稀释会促进若电解质的电离;
(4)酸性越弱,酸根离子对应的钠盐水解能力越强,pH越大。
(1)硫酸氢钠存电离方程式为:NaHSO4=Na++H++SO42-,电离出H+,使溶液显酸性,抑制水的电离,水的电离平衡向左移动,但温度不变,水的离子积常数不变;
故答案为:左;酸;不变;
(2)能水解的盐溶液促进了水的电离,碱溶液中的氢离子是水电离的,CH3COONa溶液中的氢氧根离子是水电离的,所以c(OH-)=![]() =1×10-5mol·L-1,水电离出氢离子与氢氧根离子的浓度相等,
=1×10-5mol·L-1,水电离出氢离子与氢氧根离子的浓度相等,
故答案为:1×10-5 mol·L-1;
(3)稀释会促进弱电解质的电离,故若取pH、体积均相等的NaOH和氨水分别加水稀释m倍、n稀释后pH仍相等,则氨水稀释倍数大,
故答案为:<;
(4)已知HA和HB均为弱酸,且酸性HA>HB,酸性越弱,酸根离子对应的钠盐水解能力越强,pH越大,则等浓度的NaA和NaB溶液中,PH大小关系为NaA<NaB;
故答案为:<。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3==[Ag(NH3)2]+
B.尼泊金酸(![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:![]() +2HCO3—→
+2HCO3—→![]() + 2CO2↑+2H2O
+ 2CO2↑+2H2O
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2消除酸性废水中的NO2-是一种常 用的电化学方法。其反应原理如图所示,下列说法不正确的是( )
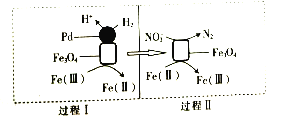
A.Fe3O4在该反应中作催化剂
B.Pd上发生的反应为H2-2e-═2H+
C.总反应为3H2+2NO2-═N2+2OH-+2H2O
D.Fe(Ⅱ)与Fe(Ⅲ)之间相互转化起到了传递电子的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氢气的燃烧热为![]() ,则电解水的热化学方程式
,则电解水的热化学方程式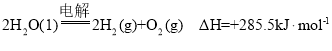
B.密闭容器中,![]() 硫粉与
硫粉与![]() 铁粉混合加热生成硫化亚铁
铁粉混合加热生成硫化亚铁![]() 时,放出
时,放出![]() 热量。
热量。![]()
C.500℃、![]() 下,将
下,将![]() 和
和![]() 置于密闭的容器中充分反应生成
置于密闭的容器中充分反应生成![]() ,放热
,放热![]() ,其热化学方程式
,其热化学方程式![]()
D.相同条件下,在两个相同的恒容密闭容器中,![]() 和
和![]() 反应放出的热量与
反应放出的热量与![]() 和
和![]() 反应放出的热量一样多
反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是药物合成中的一种重要中间体,下面是H的一种合成路线:


回答下列问题:
(1)X的结构简式为_______,其中所含官能团的名称为______;Y生成Z的反应类型为_______。
(2)R的化学名称是________。
(3)由Z和E合成F的化学方程式为__________________。
(4)同时满足苯环上有4个取代基,且既能发生银镜反应,又能发生水解反应的Y的同分异构体有________种,其中核磁共振氢谱上有4组峰,峰面积之比为1∶2∶2∶3的同分异构体的结构简式为________(一种即可)。
(5)参照上述合成路线,以乙醛和![]() 为原料(其他试剂任选),设计制备肉桂醛(
为原料(其他试剂任选),设计制备肉桂醛(![]() )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用来监测空气中NO的含量,下列说法正确的是( )
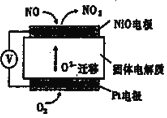
A.电子由Pt电极流出,经外电路流向NiO电极
B.Pt电极上发生的是氧化反应
C.NiO电极的电极反应式为NO+O2--2e-=NO2
D.每流经1 m3空气(假设NO被完全吸收),转移电子的物质的量为2×10-7mol,则该空气中NO的含量约为3×10-2mg/m3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制备1,2-二溴乙烷的反应原理如下:①乙醇在浓硫酸的存在下制取乙烯、②乙烯与溴反应制得1,2-二溴乙烷。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:

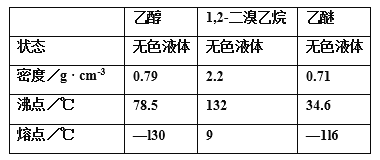
回答下列问题:
(1)写出乙醇在浓硫酸的存在下制取乙烯的化学方程式______________;浓硫酸所起的作用是___________ 。
(2)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______;(填正确选项前的字母)
a.引发反应 b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(3)反应一段时间后三颈烧瓶A中的液体混合物会逐渐变黑,此时会发生另一个副反应生成其他酸性杂质气体,该反应的化学方程式为_________ 。
(4)在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是________________;
(6)若产物中有少量副产物乙醚,可用_____________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com