
����Ŀ��ijС����ʵ�����о��ܼ������������������Ʒ�Ӧ��Ӱ�죬��ش��������⣺
ʵ��1����������������NaOHˮ��Һ��ϣ����ȡ�
(1)����Br����ȡ��Ӧ������___��Һ��(����������������)�������м���________(���Լ�)���۲쵽�е���ɫ�������ɡ�
(2)�����Ҵ�����__________________(�������)���������������Ҵ����ɴ˿�֪�÷�Ӧ����Ϊ_____________��
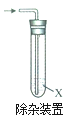
ʵ��2����������������NaOH�Ҵ���Һ��ϣ����ȡ�
(3)������ϩ������Ӧ����������ͨ���Ҳ��Թ��У��۲쵽��Һ��ɫ���Լ�X��_____________
(4)д����������NaOH�Ҵ���Һ��Ӧ�Ļ�ѧ����ʽ_________________
ʵ����ۣ�
(5)��ʵ��1��2�ó��Ľ�����_______________________________
���𰸡��� �����ữ�������� ������� ˮ�ⷴӦ����ȡ����Ӧ�� Br2/CCl4 CH3CH2Br+ NaOH![]() CH2 = CH2�� + NaBr +H2O ��������NaOH��ˮ��Һ���ȷ���ˮ�ⷴӦ����������NaOH�Ĵ���Һ���ȷ�����ȥ��Ӧ���Լ���ͬ�������ķ�Ӧ����Ҳ��ͬ
CH2 = CH2�� + NaBr +H2O ��������NaOH��ˮ��Һ���ȷ���ˮ�ⷴӦ����������NaOH�Ĵ���Һ���ȷ�����ȥ��Ӧ���Լ���ͬ�������ķ�Ӧ����Ҳ��ͬ
��������
ʵ��1����������������NaOHˮ��Һ��ϣ����ȣ���Ӧ�����Ҵ����廯�ƣ����������顢�����Ӻ��Ҵ������ʷ������(1)(2)��ʵ��2����������������NaOH�Ҵ���Һ��ϣ����ȣ���Ӧ������ϩ���廯�ƣ������ϩ�����ʷ������(3)(4)������ʵ��1��2�ķ������ɳ�ʵ����ۡ�
(1) ��������������NaOHˮ��Һ��ϣ����ȣ���Ӧ�����Ҵ����廯�ơ�������������ˮ���ܶȴ���ˮ��ȡ��Ӧ�������ϲ�Һ�壬�����м��������ữ�����������۲쵽�е���ɫ�������ɣ�˵�������������ӣ��ʴ�Ϊ�����������ữ����������
(2)�Ҵ��к����ǻ��������ú����������������Ҵ����ɴ˿�֪�÷�Ӧ����Ϊȡ����Ӧ��ˮ�ⷴӦ���ʴ�Ϊ�����������ˮ�ⷴӦ(��ȡ����Ӧ)��
(3) ��������������NaOH�Ҵ���Һ��ϣ����ȣ���Ӧ������ϩ���廯������ϩ�к���̼̼˫��������Ӧ����������ͨ���Ҳ��Թ��У��۲쵽��Һ��ɫ�����Լ�XΪBr2��CCl4��Һ���ʴ�Ϊ��Br2/CCl4��
(4)��������NaOH�Ҵ���Һ������ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽΪCH3CH2Br+ NaOH![]() CH2 = CH2 ��+ NaBr +H2O���ʴ�Ϊ��CH3CH2Br+ NaOH
CH2 = CH2 ��+ NaBr +H2O���ʴ�Ϊ��CH3CH2Br+ NaOH![]() CH2 = CH2 ��+ NaBr +H2O��
CH2 = CH2 ��+ NaBr +H2O��
(5)��ʵ��1��2��֪����������NaOH��ˮ��Һ���ȷ���ˮ�ⷴӦ����������NaOH�Ĵ���Һ���ȷ�����ȥ��Ӧ���Լ���ͬ�������ķ�Ӧ����Ҳ��ͬ���ʴ�Ϊ����������NaOH��ˮ��Һ���ȷ���ˮ�ⷴӦ����������NaOH�Ĵ���Һ���ȷ�����ȥ��Ӧ���Լ���ͬ�������ķ�Ӧ����Ҳ��ͬ��


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д� ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Բ��ϲ�ҵ��21���������չ�ĸ߿Ƽ�֧����ҵ֮һ�����Բ��Ϲ㷺���ڵ�����Ϣ�����¼���������̼������Ҫ�����Ʊ����������壬��ҵ�����Ȼ�隣����̿���Ʊ��ߴ���̼���̵Ĺ����������£�

��֪�����̿�۵���Ҫ�ɷ���MnCO3����������Fe��Al��Ca��Mg��Ԫ�ء�
����ؽ���Mn+����c(Mn+) �T 0.1 mol L -1�γ�M(OH) n������pH��Χ���£�

�۳����£�Ksp(CaF2) �T1.46��10-10 Ksp(MgF2) �T7.42��10-11 Ka(HF) �T1.00 ��10-4
�ش��������⣺
��1����������ͼ1��ͼ2���Ȼ�隣����̿�۵���������ǣ�__________________��

��2�������ա�ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_________________________��
��3������Һ���������ӡ��������£����ȼ���MnO2��Fe2+����ΪFe3+����Ӧ�����ӷ���ʽΪ__________���ٵ�����Һ��pH��Al3+��Fe3+��Ϊ������ȥ��Ȼ�����NH4F��Ca2+��Mg2+������ȥ����ʱ��ҺpHΪ6��c(Mg2+)�T4.64��10-6 mol��L-1��c(HF)Ϊ_________mol��L-1��
��4��̼���ᾧʱ����Ӧ�����ӷ���ʽΪ_____________________________________��
��5��̼���ᾧ�����в�����̼�����Һ����̼�������Һ���ܵ�ԭ����___________________��
��6���ⶨ̼���̲�Ʒ�Ĵ��ȡ�
��ȡ0.5000 g̼���̲�Ʒ����ƿ�У���25.00 mL���ᣬ���ȣ�̼����ȫ��ת��Ϊ[Mn(PO4)2]3-����ȴ�����¡���ˮϡ����100 mL���μ�2��3��ָʾ����Ȼ����Ũ��Ϊ0.2000 mol��L-1�����������[(NH4)2Fe(SO4)2]����Һ�ζ�����ӦΪ��[Mn(PO4)2]3- +Fe2+ �TMn2+ +Fe3++2PO43-�����ظ�����3�Σ���¼�������±���
�ζ����� | 0.2000 mol��L-1����������隣���Һ������mL�� | |
�ζ�ǰ | �ζ��� | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
���Ʒ�Ĵ���=__________�����ζ��յ�ʱ���ֵζ��ܼ��촦���������ݣ����õ�̼���̴ֲ�Ʒ�Ĵ���___(�ƫ�ߡ��� ƫ�͡�����Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���ķ���ʽ��C6H8O4�����ڸ÷��ӵĽṹ�Ʋ��������
A. ���ܺ���1������
B. ���ܺ�������̼̼������4���ǻ�
C. ���ܺ���2���Ȼ���1��̼̼˫��
D. ���ܺ���1��ȩ����1���Ȼ���1��̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܵĺϽ����������;�dz��㷺����֪![]() ��
��![]() �������Ը�ǿ����ˮ��Һ�в��ܴ�������.
�������Ը�ǿ����ˮ��Һ�в��ܴ�������.
(1)![]() �ĺ�������Ų�ʽΪ_____________��
�ĺ�������Ų�ʽΪ_____________��
(2)��ˮ![]() ���۵�Ϊ
���۵�Ϊ![]() ���е�Ϊ
���е�Ϊ![]() ��
��![]() �۵�Ϊ
�۵�Ϊ![]() ���е�Ϊ
���е�Ϊ![]() ��
��![]() ����_______���壬
����_______���壬![]() ����_____���塣
����_____���塣
(3)![]() �����ڼ��������ȣ�����
�����ڼ��������ȣ�����![]() ��
��![]() ��
��![]() ����Ӧ�Ʊ�.
����Ӧ�Ʊ�.
��![]() �Ŀռ乹��Ϊ______________________��
�Ŀռ乹��Ϊ______________________��
��![]() �Ļ�ѧʽΪ
�Ļ�ѧʽΪ![]() ����
����![]() (III)�γ���λ����ԭ����_____
(III)�γ���λ����ԭ����_____
��֪![]() �Ľṹʽ��
�Ľṹʽ��![]()
��![]() ����
����![]() (˫���谷)Ϊԭ���Ʊ���
(˫���谷)Ϊԭ���Ʊ���![]() ˫���Ȱ������к�
˫���Ȱ������к�![]() ������ĿΪ___________��
������ĿΪ___________��
(4)![]() ��
��![]() ���ÿ�����
���ÿ�����![]() ����ṹ��ͼ��ʾ���÷�����
����ṹ��ͼ��ʾ���÷�����![]() ԭ�ӵ��ӻ���ʽΪ_____________________________��
ԭ�ӵ��ӻ���ʽΪ_____________________________��

(5)������dz���﮵�صĵ缫���ϣ��侧���ṹ��ͼ��ʾ���þ�������ԭ�ӵ���ĿΪ______����֪![]() Ϊ�����ӵ���������ֵ����þ������ܶ�Ϊ______(�ú�
Ϊ�����ӵ���������ֵ����þ������ܶ�Ϊ______(�ú�![]() ��
��![]() ��
��![]() �Ĵ���ʽ��ʾ)
�Ĵ���ʽ��ʾ)![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ϳ���ȼ�շ�ȷ���л������ɡ���ȷ��ȡ0.44gij�л�����Ʒ�������ȼ�պ�����ͨ��Ũ����ͼ�ʯ�ң��ֱ�����0.36g��0.88g.
(1)����л����ʵ��ʽΪ___________
(2)��֪�������ܶ�Ϊͬ������H2��22�������л���ķ���ʽΪ___________
(3)���л���ĺ˴Ź�����������2���壬�����֮��Ϊ1:3����ṹ��ʽΪ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��е�28��Ԫ��Ni����Ҫ����;���������õ����¡���ʴ������ܣ��ڵ�ء���������Ҳ�й㷺Ӧ�á���ҵ����������(������������ͭ��������)Ϊԭ���Ʊ����������Ļ����������£�

��֪���缫��λ(E)����������������ԭ����ǿ�����磺
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)�������ڱ��е�λ��Ϊ_______________________________��
(2)����������ϸĥ������______________________________________��
(3)��ɫ��Ӧʵ������ù���������˿���沬˿պȡ��ѧ�Լ����գ�ԭ����______________________��
(4)��������ʱ�����Ļ�ѧ��Ӧ����ʽ___________________________________��������������ʽ��ʾ)��
(5)����ƴ���ʱ������������Ҫ�缫��Ӧʽ_____________________________________��
(6)��ҵ����NiSO4��Һ�Ƶ�Ni(OH)2���ٵμ�NaC1O��Һ���μӹ����з�����Ӧ�����ӷ���ʽΪ_________________________________________________________��
(7)��⾫�����Ĺ��������pHΪ2��5���Է���ԭ��______________________________��������ijɷ�Ϊ________________(д����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪M��N�Ǻϳ�ij���ܸ߷��Ӳ��ϵ��м������й���M��N˵����ȷ���ǣ� ��
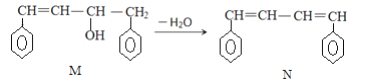
A. M��N������ϩ�������Ȳ���ͬϵ�Ҳ����ͬ���칹��
B. M��N�ֱ���Һ���ϣ�������ȡ����Ӧ
C. M��N���Ӿ�����������ԭ�ӹ�ƽ��
D. M��N���ɷ����Ӿ۷�Ӧ���ɸ߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ԫ��A��B��C��D��E��ԭ��������������A��B��C��D����Ԫ�غ˵������С��20��A��Bͬ���壻B��C��DԪ�صĻ�̬ԭ�Ӿ�����ͬ���ܲ��������ǵĻ�̬ԭ����p�ܼ���δ�ɶԵ������ֱ�Ϊ1��3��1��E�����ڱ��У���������Ԫ���⣩��һ��������С��Ԫ�ء��ش��������⣺
��1��д������Ԫ�صķ��ţ�A ��E ��
��2��CԪ�صļ۵����Ų�ͼΪ�� ��
���Ų���ѭ��ԭ����Ҫ�У� ���������÷֣���
��3��C��DԪ���γɵĻ�������Ҫ�У� ���ѧʽ���������÷֣���������Է���������С�ķ���Ϊ ���ӣ����������������Ǽ����������÷��ӵĿռ乹��Ϊ ������ԭ�ӵ��ӻ���ʽ�� ��
��4��������BD3���۵�190�����е�182.7������ôBD3�ľ�������Ϊ ����ʵ�ϣ���BD3�Ļ�������������B2D6����ʽ���ڣ�����ʽ�Ĵ��������� �γɵġ���ѡ����������������»������������Ӽ���������λ������
��5����ͼΪ���־���������1/8��ʾ��ͼ������![]() ��
��![]() �������ֲ�ͬ�����ӡ�E��D�γɵĻ�����ľ����������е� ������ţ����ڸþ����������ӵ���λ��Ϊ ��
�������ֲ�ͬ�����ӡ�E��D�γɵĻ�����ľ����������е� ������ţ����ڸþ����������ӵ���λ��Ϊ ��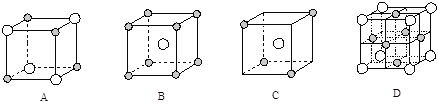
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���5.6g����4.6g�Ʒֱ���100m L 1mol/L�����ᷴӦ ����ų�H2������� ��
A. ���Ķ� B. �ƵĶ� C. �����Ʒų�һ���� D. ���Ƚ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com