
【题目】钴的合金及其配合物用途非常广泛。已知![]() 比
比![]() 的氧化性更强,在水溶液中不能大量存在.
的氧化性更强,在水溶液中不能大量存在.
(1)![]() 的核外电子排布式为_____________。
的核外电子排布式为_____________。
(2)无水![]() 的熔点为
的熔点为![]() 、沸点为
、沸点为![]() ,
,![]() 熔点为
熔点为![]() 、沸点为
、沸点为![]() .
.![]() 属于_______晶体,
属于_______晶体,![]() 属于_____晶体。
属于_____晶体。
(3)![]() 可用于激光起爆器等,可由
可用于激光起爆器等,可由![]() 、
、![]() 、
、![]() 共反应制备.
共反应制备.
①![]() 的空间构型为______________________。
的空间构型为______________________。
②![]() 的化学式为
的化学式为![]() ,与
,与![]() (III)形成配位键的原子是_____
(III)形成配位键的原子是_____
已知![]() 的结构式是
的结构式是![]()
③![]() 可以
可以![]() (双聚氰胺)为原料制备,
(双聚氰胺)为原料制备,![]() 双聚氯胺分子中含
双聚氯胺分子中含![]() 键的数目为___________。
键的数目为___________。
(4)![]() 与
与![]() 作用可生成
作用可生成![]() ,其结构如图所示,该分子中
,其结构如图所示,该分子中![]() 原子的杂化方式为_____________________________。
原子的杂化方式为_____________________________。

(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为______。已知![]() 为阿伏加德罗常数的数值,则该晶胞的密度为______(用含
为阿伏加德罗常数的数值,则该晶胞的密度为______(用含![]() 、
、![]() 、
、![]() 的代数式表示)
的代数式表示)![]()
【答案】![]() 离子 分子 正四面体
离子 分子 正四面体 ![]() 和
和
![]() (或
(或![]() )
) ![]() 和
和![]() 6
6 ![]()
【解析】
(1)Co是27号元素,其原子核外有27个电子,失去3d上1个电子和4s上2个电子生成Co3+离子,根据构造原理知Co3+基态的电子排布式;
(2)分子晶体熔沸点较低,离子晶体熔沸点较高,据此解答;
(3)①![]() 中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个
中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个![]() 键,中心原子采取sp3杂化,则空间构型为正四面体。
键,中心原子采取sp3杂化,则空间构型为正四面体。
②![]() 分子中,
分子中,![]() (III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键;
(III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键;
③所有单键为![]() 键,双键中有一个
键,双键中有一个![]() 键,由结构式
键,由结构式![]() 可知,
可知,![]() 键数为9;
键数为9;
(4) Co3+有空轨道,而CO有孤电子对,故二者可形成配位键;从结构图中可看出C有的形成两个键,有的形成3个键,故杂化类型分别为sp和sp2杂化;
(5) 题图中原子的堆积方式为六方最密堆积。1pm=1010cm,六棱柱底部正六边形的面积=6![]() (a
(a![]() 10-10)2cm2,六棱柱的体积=6
10-10)2cm2,六棱柱的体积=6![]() (a
(a![]() 10-10)2(b
10-10)2(b![]() 10-10)cm3=3
10-10)cm3=3![]() a2b
a2b![]() 10-30cm3。该晶胞中氧原子的数目为12
10-30cm3。该晶胞中氧原子的数目为12![]() +6
+6![]() +2
+2![]() +1=6,Li原子的数目为3,Co原子的数目为3,已知
+1=6,Li原子的数目为3,Co原子的数目为3,已知![]() 为阿伏加德罗常数的数值,则一个晶胞的质量为
为阿伏加德罗常数的数值,则一个晶胞的质量为![]() g,代入公式
g,代入公式![]() =
=![]() 计算。
计算。
(1)钴是27号元素,根据构造原理可以写出钴离子的核外电子排布式为:![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
(2)无水![]() 的熔沸点较高,则
的熔沸点较高,则![]() 属于离子晶体,氯化铁熔沸点较低,则氯化铁属于分子晶体,
属于离子晶体,氯化铁熔沸点较低,则氯化铁属于分子晶体,
因此,本题正确答案是:离子;分子;
(3)①![]() 中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个
中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个![]() 键,中心原子采取sp3杂化,则空间构型为正四面体。
键,中心原子采取sp3杂化,则空间构型为正四面体。
②![]() 分子中,
分子中,![]() (III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键,所以与
(III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键,所以与![]() (III)形成配位键的原子是
(III)形成配位键的原子是![]() 和
和![]() ,
,
③所有单键为![]() 键,双键中有一个
键,双键中有一个![]() 键,由结构式
键,由结构式![]() 可知,
可知,![]() 键数为9,则
键数为9,则![]() 双聚氯胺分子中
双聚氯胺分子中![]() 键的数目为
键的数目为![]() 。
。
因此,本题正确答案是:正四面体;![]() 和
和![]() ;
;![]() (或
(或![]() );
);
(4)从结构图中可看出C有的形成两个键,有的形成3个键,故杂化类型分别为sp和sp2杂化,
因此,本题正确答案是:sp和sp2。
(5)题图中原子的堆积方式为六方最密堆积。1pm=1010cm,六棱柱底部正六边形的面积=6![]() (a
(a![]() 10-10)2cm2,六棱柱的体积=6
10-10)2cm2,六棱柱的体积=6![]() (a
(a![]() 10-10)2(b
10-10)2(b![]() 10-10)cm3=3
10-10)cm3=3![]() a2b
a2b![]() 10-30cm3。该晶胞中氧原子的数目为12
10-30cm3。该晶胞中氧原子的数目为12![]() +6
+6![]() +2
+2![]() +1=6,Li原子的数目为3,Co原子的数目为3,已知
+1=6,Li原子的数目为3,Co原子的数目为3,已知![]() 为阿伏加德罗常数的数值,则一个晶胞的质量为
为阿伏加德罗常数的数值,则一个晶胞的质量为![]() g,故密度为
g,故密度为![]() =
=![]() =
=![]() 。
。
因此,本题正确答案是:![]() 。
。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为14.4 g,若其中水的质量为7.2 g,则CO的质量是 ( )。
A. 2.8 gB. 4.4 gC. 5.6 gD. 在2.8 g~5.6 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 。室温下用
。室温下用![]() 的
的![]() 滴定
滴定![]() 某一元酸
某一元酸![]() 的结果如图所示,下列说法中正确的是
的结果如图所示,下列说法中正确的是

A. ![]() 属于弱酸
属于弱酸
B. 整个过程中,![]() 点时水的电离程度最大
点时水的电离程度最大
C. ![]() 点对应液中
点对应液中![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学探究小组为探究电化学原理,设计了如下图所示的装置进行探究实验。下列对实验中观察到的现象或有关结论错误的是 ( )

A.a和b不连接时,铁片上有红色的铜析出,该装置不能形成原电池
B.a和b用导线连接时铜片为负极,发生的反应为:Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成
D.a和b用导线连接时,溶液中的Cu2+应向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】求下列溶液的pH(常温条件下,已知lg2=0.3,lg5=0.7,lg5.5=0.74)
(1)0.0005mol/L的硫酸溶液pH=________.(2)0.0005mol/L的氢氧化钠溶液pH=_________.
(3)把10ml,pH=12的氢氧化钡加水稀释到1LpH=______________.
(4)将pH=1的盐酸和pH=4的硫酸等体积混合pH=_______________.
(5)将pH=1的盐酸aL和pH=11的氢氧化钠bL溶液混合,若混合液为中性,则a:b=_______.
(6)将pH=3与pH=4的稀硫酸等体积混合时,混合后溶液的pH=_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
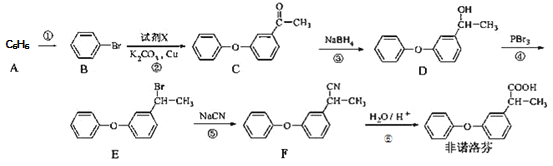
回答下列问题
(1)![]() 的化学名称是_____________,
的化学名称是_____________,![]() 中含氧官能团的名称为___________。
中含氧官能团的名称为___________。
(2)上述反应中,反应①的条件是___________,过程①属于______反应
(3)反应②发生的是取代反应,且另一种产物有![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式______。
的化学方程式______。
(4)有机物![]() 与非诺芬互为同分异构体,
与非诺芬互为同分异构体,![]() 满足下列条件:
满足下列条件:
I.能与NaHCO3溶液反应,且能与FeCl3溶液发生显色反应
II.分子中有6种不同化学环境的氢,且分子中含有两个苯环
![]() 的结构有_____种,写出其中一种不能与浓溴水发生取代反应的
的结构有_____种,写出其中一种不能与浓溴水发生取代反应的![]() 的结构简式_________。
的结构简式_________。
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 路线流程图(无机试剂任用)_________
路线流程图(无机试剂任用)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在实验室研究溶剂对溴乙烷与氢氧化钠反应的影响,请回答下列问题:
实验1:将溴乙烷与适量NaOH水溶液混合,加热。
(1)检验Br﹣:取反应后所得___层液体(填“上”或“下”),向其中加入________(填试剂),观察到有淡黄色沉淀生成。
(2)检验乙醇:用__________________(填波谱名称)检验生成物中有乙醇,由此可知该反应类型为_____________。
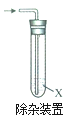
实验2:将溴乙烷与适量NaOH乙醇溶液混合,加热。
(3)检验乙烯:将反应产生的气体通入右侧试管中,观察到溶液褪色,试剂X是_____________
(4)写出溴乙烷与NaOH乙醇溶液反应的化学方程式_________________
实验结论:
(5)由实验1、2得出的结论是_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。某化学兴趣小组用某浓度的Na2CO3溶液处理一定量的CaSO4固体,测得所加Na2CO3溶液体积与溶液中-lgc(CO32-)的关系如下。
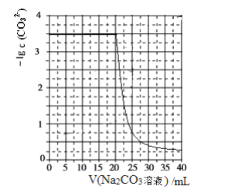
已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列说法不正确的是( )
A. 曲线上各点的溶液满足关系式:c(Ca2+)·c(SO42-)=Ksp(CaSO4)
B. CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq) K=3×103
CaCO3(s)+SO42-(aq) K=3×103
C. 该Na2CO3溶液的浓度为1mol/L
D. 相同实验条件下,若将Na2CO3溶液的浓度改为原浓度的2倍,则上图曲线整体向上平移1个单位即可
查看答案和解析>>
科目:高中化学 来源: 题型:
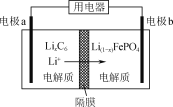
【题目】LiFePO4是一种电动汽车电池的电极材料,实验室以绿矾和磷酸为原料制备LiFePO4的流程如下:

(1)“溶解”和“反应1”步骤不能互换的原因是________。
(2)“反应1”的离子方程式是________。
(3)“反应2”是2LiOH+6H2C2O4+2FePO4===2LiFePO4+7CO2↑+5CO↑+7H2O,其中体现氧化性和还原性的反应物的物质的量之比为________。
(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是:①________,②________。
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时电极b的电极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com