
【题目】LiFePO4是一种电动汽车电池的电极材料,实验室以绿矾和磷酸为原料制备LiFePO4的流程如下:

(1)“溶解”和“反应1”步骤不能互换的原因是________。
(2)“反应1”的离子方程式是________。
(3)“反应2”是2LiOH+6H2C2O4+2FePO4===2LiFePO4+7CO2↑+5CO↑+7H2O,其中体现氧化性和还原性的反应物的物质的量之比为________。
(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是:①________,②________。
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时电极b的电极反应式为_________。
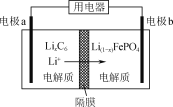
【答案】可能导致FePO4中混有较多Fe(OH)3 2Fe2++ClO-+2H3PO4+4OH-===2FePO4↓+Cl-+5H2O 9∶7 改善成型后LiFePO4(或电极)的导电作用 与空气中O2反应,防止LiFePO4中的Fe2+被氧化 Li(1-x)FePO4+xLi++xe-===LiFePO4
【解析】
(1)“溶解”时溶液保持酸性,抑制亚铁离子的水解,保持离子浓度较高,“反应1”生成FePO4,步骤不能互换,否则可能导致FePO4中混有较多Fe(OH)3;
(2)“反应1”在磷酸存在下,加入氢氧化钠时亚铁离子被次氯酸根离子氧化生成FePO4,反应的离子方程式是2Fe2++ClO-+2H3PO4+4OH-===2FePO4↓+Cl-+5H2O;
(3)“反应2”是2LiOH+6H2C2O4+2FePO4===2LiFePO4+7CO2↑+5CO↑+7H2O,反应中碳元素由+3价降为+2价、铁元素由+3价降为+2价;碳元素由+3价升为+4价,根据氧化还原反应原理,每生成2molLiFePO4,则生成7mol CO2,转移7mole-,故体现氧化性的反应物H2C2O4、FePO4和还原性的反应物H2C2O4的物质的量之比为(2.5+2):3.5=9:7;
(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是:①改善成型后LiFePO4(或电极)的导电作用,②与空气中O2反应,防止LiFePO4中的Fe2+被氧化;
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时锂离子通过隔膜向电极b移动,则电极b为正极,电极上Li+得电子产生LiFePO4,电极反应式为Li(1-x)FePO4+xLi++xe-===LiFePO4。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】钴的合金及其配合物用途非常广泛。已知![]() 比
比![]() 的氧化性更强,在水溶液中不能大量存在.
的氧化性更强,在水溶液中不能大量存在.
(1)![]() 的核外电子排布式为_____________。
的核外电子排布式为_____________。
(2)无水![]() 的熔点为
的熔点为![]() 、沸点为
、沸点为![]() ,
,![]() 熔点为
熔点为![]() 、沸点为
、沸点为![]() .
.![]() 属于_______晶体,
属于_______晶体,![]() 属于_____晶体。
属于_____晶体。
(3)![]() 可用于激光起爆器等,可由
可用于激光起爆器等,可由![]() 、
、![]() 、
、![]() 共反应制备.
共反应制备.
①![]() 的空间构型为______________________。
的空间构型为______________________。
②![]() 的化学式为
的化学式为![]() ,与
,与![]() (III)形成配位键的原子是_____
(III)形成配位键的原子是_____
已知![]() 的结构式是
的结构式是![]()
③![]() 可以
可以![]() (双聚氰胺)为原料制备,
(双聚氰胺)为原料制备,![]() 双聚氯胺分子中含
双聚氯胺分子中含![]() 键的数目为___________。
键的数目为___________。
(4)![]() 与
与![]() 作用可生成
作用可生成![]() ,其结构如图所示,该分子中
,其结构如图所示,该分子中![]() 原子的杂化方式为_____________________________。
原子的杂化方式为_____________________________。

(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为______。已知![]() 为阿伏加德罗常数的数值,则该晶胞的密度为______(用含
为阿伏加德罗常数的数值,则该晶胞的密度为______(用含![]() 、
、![]() 、
、![]() 的代数式表示)
的代数式表示)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A、B、C、D和E的原子序数依次增大。A、B、C、D四种元素核电荷数均小于20,A、B同主族;B、C、D元素的基态原子具有相同的能层数,它们的基态原子中p能级上未成对电子数分别为1、3、1;E是周期表中(除放射性元素外)第一电离能最小的元素。回答下列问题:
(1)写出下列元素的符号:A 、E 。
(2)C元素的价电子排布图为: ;
该排布遵循的原理主要有: (答完整得分)。
(3)C、D元素形成的化合物主要有: (填化学式,答完整得分);其中相对分子质量较小的分子为 分子(填“极性”或“非极性”),该分子的空间构型为 ,中心原子的杂化方式是 。
(4)化合物BD3的熔点190℃、沸点182.7℃,那么BD3的晶体类型为 ;事实上,在BD3的化合物中往往以B2D6的形式存在,该形式的存在是由于 形成的。(选填“氢键”、“范德华力”、“离子键”、“配位键”)
(5)下图为几种晶胞(或晶胞的1/8)示意图,其中![]() 和
和![]() 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。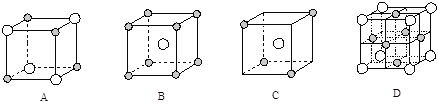
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
利用丙炔和苯甲醛研究碘代化合物与苯甲醛在 Cr-Ni 催化下可以发生偶联反应和合成 重要的高分子化合物Y的路线如下:

已知:①R1CHO+R2CH2CHO![]()
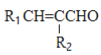 +H2
+H2
②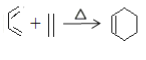
回答下列问题:
(1)A的化学名称为____。
(2)B中含氧官能团的名称是______。
(3)X的分子式为_______。
(4)反应①的反应类型是________。
(5)反应②的化学方程式是_______。
(6)L是D的同分异构体,属于芳香族化合物,与D具有相同官能团,其核磁共振氢谱为5组峰,峰面积比为3:2:2:2:1,则L的结构简式可能为_____。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、CH3CHO、
、CH3CHO、![]() 合成多环化合物
合成多环化合物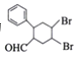 的路线(无机试剂任选)______。
的路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将5.6g铁和4.6g钠分别与100m L 1mol/L的盐酸反应 ,则放出H2的体积( )
A. 铁的多 B. 钠的多 C. 铁和钠放出一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是( )
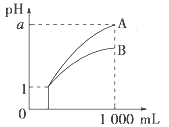
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示可逆反应:mA(g) + nB(g) ![]() xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是
xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是

A. 上述反应是放热反应
B. 上述反应是吸热反应
C. m+n<x
D. m+n>x
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com