
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
【答案】1s22s22p63s23p63d5或[Ar]3d5 N>O>S sp2 分子晶体 正四面体形 10 CN-或C22- 3:1 12 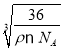 ×1010
×1010
【解析】
(1)铁为26号元素,电子排布式为1s22s22p63s23p63d64s2,失去4s能级上的2个电子,形成Fe2+,再失去3d能级上的1个电子后形成Fe3+;
(2)同周期从左向右第一电离能逐渐增大,同主族从上到下第一电离能逐渐减小;苯酚可看成分子中的一个氢原子被羟基取代,苯和苯酚均为平面结构,碳原子均为sp2杂化;
(3)分子晶体熔沸点较低且熔融状态不导电;根据SO42-中心原子含有的共价键个数与孤电子对数之和确定空间构型;
(4)配合物中碳原子不存在孤电子对,σ键由2个,即1个Fe(CO)5中含有10个σ键;原子数目相等,价电子总数相等的微粒为等电子体;
(5)氮化铁晶体为六棱柱,顶点为6个晶胞共有,面心的点为2个晶胞共有,晶胞中12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于内部,2个氮原子位于内部,因此据此可计算微粒个数比;
(6)以Fe2+顶点研究,与Fe2+紧邻且等距离的Fe2+处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用;Fe2+与O2-的最短核间距等于晶胞棱长的![]() ,均摊法计算晶胞中Fe2+与O2-的离子数目,计算出晶胞的质量,与密度公式结合进行计算。
,均摊法计算晶胞中Fe2+与O2-的离子数目,计算出晶胞的质量,与密度公式结合进行计算。
(1)铁原子失去4s能级上的2个电子和3d能级上的1个电子后形成Fe3+,因此基态Fe3+的电子排布式为1s22s22p63s23p63d5或[Ar]3d5;
(2)同主族从上到下第一电离能逐渐减小,即第一电离能O>S,同周期从左向右第一电离能逐渐增大,但氮元素2p能级处于半满的稳定状态,能量低,因此第一电离能N>O,所以第一电离能N>O>S;苯酚可看成分子中的一个氢原子被羟基取代,苯和苯酚均为平面结构,碳原子均为sp2杂化
(3)FeCl3的熔点为306℃,沸点为315℃,熔沸点较低,属于分子晶体;SO42-中心S原子的σ键电子对数为4,中心原子孤电子对数为0,价层电子对数为4,立体构型为正四面体形;
(4)配合物中碳原子不存在孤电子对,σ键由2个,即1个Fe(CO)5中含有10个σ键,那么1 mol Fe(CO)5分子中含10molσ键;原子数目相等,价电子总数相等的微粒为等电子体,与CO互为等电子体的离子有CN-或者C22-;
(5)氮化铁晶体为六棱柱,顶点为6个晶胞共有,面心的点为2个晶胞共有,晶胞中12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于内部,2个氮原子位于内部,因此晶胞中含有铁微粒12×![]() +2×
+2×![]() +3=6,氮微粒的个数为2,所以铁、氮的微粒个数之比为6:2=3:1;
+3=6,氮微粒的个数为2,所以铁、氮的微粒个数之比为6:2=3:1;
(6)以Fe2+顶点研究,与Fe2+紧邻且等距离的Fe2+处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用,因此与Fe2+紧邻且等距离的Fe2+数目为![]() =12个;晶胞中Fe2+共8×
=12个;晶胞中Fe2+共8×![]() +6×
+6×![]() =4,O2-的数目为1+12×
=4,O2-的数目为1+12×![]() =4,晶胞的质量为
=4,晶胞的质量为![]() ,Fe2+与O2-的最短核间距等于晶胞棱长的
,Fe2+与O2-的最短核间距等于晶胞棱长的![]() ,设最短距离为xpm,则晶胞的棱长为2xpm,那么
,设最短距离为xpm,则晶胞的棱长为2xpm,那么![]() =ρ(2x×10-10)3,解得x=
=ρ(2x×10-10)3,解得x= ×1010pm。
×1010pm。


科目:高中化学 来源: 题型:
【题目】下列表达方式或说法正确的是( )
A. 基态到激发态产生的光谱是发射光谱
B. 氯化铵的电子式:
C. NH3、H2O、CO2、HCl 四分子中孤电子对最多的是 CO2
D. 硫离子的核外电子排布式 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生活中的一种常见有机物,它的分子结构模型如图所示。

(1)写出乙酸的分子式 _________,结构式 ____________乙酸中官能团的名称____________。
(2)乙酸与![]() 溶液反应产生的气体是__________(填分子式)。
溶液反应产生的气体是__________(填分子式)。
(3)一定条件下,乙酸能与乙醇发生反应成一种具有香味的油状液体,请写出反应的化学方程式:_______________。该反应的类型是________反应。
(4)请设计实验证明乙酸的酸性强于苯酚(写出操作及现象)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3==[Ag(NH3)2]+
B.尼泊金酸(![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:![]() +2HCO3—→
+2HCO3—→![]() + 2CO2↑+2H2O
+ 2CO2↑+2H2O
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制取乙酸乙酯。
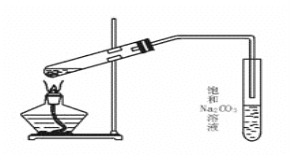
(1)加热前,大试管中加入几粒碎瓷片的作用是___,导气管不能插入饱和Na2CO3溶液中是为了___。
(2)饱和Na2CO3溶液的作用是___、___、___。
(3)实验室生成的乙酸乙酯,其密度比水___(填“大”或“小”),有___气味。
查看答案和解析>>
科目:高中化学 来源: 题型:
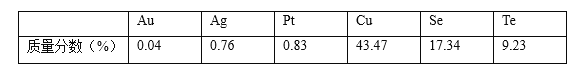
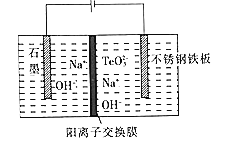
【题目】全国第十届环境化学大会于2019年8月15日在天津召开,其中一项会议的议题为“矿山环境与污染控制“。纳米铜线由于具有独特的光学、电学、力学和热学性质而成为制备透明柔性导电电极的优良材料。某精铜矿渣(主要成分为Cu、Cu2Se和Cu2Te)中除含有铜、硒(Se)、碲(Te)外,还含有少量贵金属,部分元素质量分数如表:
纳米铜线的制备与硒、碲的主要回收流程如图:
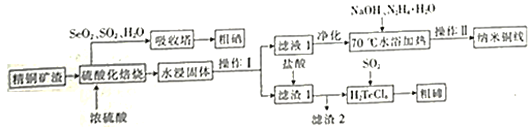
(1)16S、34Se、52Te为同主族元素,其中52Te在元素周期表中的位置为______。
(2)经过硫酸化焙烧,Cu、Cu2Se和Cu2Te转化为CuSO4,SeO2和TeO2.其中Cu2Te硫酸化培烧的化学方程式为______。
(3)吸收塔内发生的反应中氧化剂与还原剂的物质的量之比为______。
(4) “水浸固体”过程中补充少量氯化钠固体,可减少固体中的硫酸银进人滤液1中,从平衡移动原理角度解释其原因:______。
(5) “70℃水浴加热”时发生反应的离子方程式为______。水浴加热段时间后,溶液中出现线状悬浮物,先过滤,后水洗,再用______洗涤、干燥,可以得到纳米铜线。
(6)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。 研究发现在低电流密度碱性的条件下。增加TeO32-的浓度,可以促进Te的沉积。Te 沉积的电极反应式为______,其中Na+向______(填“石 墨”或“不锈钢铁板“)电极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲证明乙炔能与KMnO4酸性溶液反应,实验方案如下:将电石与水反应生成的气体通入KMnO4酸性溶液,溶液褪色,证明二者发生了反应。请回答:
(1)制备乙炔的反应的化学方程式是_______。
(2)该同学的实验方案存在的问题是______。
(3)为了解决上述问题,需重新选择实验装置,备选装置如图所示。
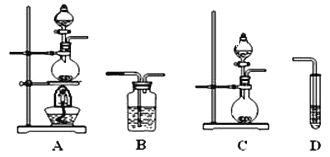
①将装置编号按顺序填在横线上___→B→__________。
②B装置中所盛放的试剂是____________。
(4)乙炔使酸性KMnO4溶液褪色的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2消除酸性废水中的NO2-是一种常 用的电化学方法。其反应原理如图所示,下列说法不正确的是( )
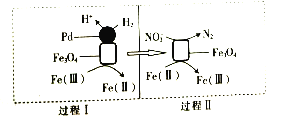
A.Fe3O4在该反应中作催化剂
B.Pd上发生的反应为H2-2e-═2H+
C.总反应为3H2+2NO2-═N2+2OH-+2H2O
D.Fe(Ⅱ)与Fe(Ⅲ)之间相互转化起到了传递电子的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com