
【题目】如图所示,将浸透了石蜡油的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,关于该实验的分析正确的是( )

A.石棉的作用是催化剂
B.碎瓷片的作用是防暴沸
C.若小试管中的液体是酸性高锰酸钾,则其褪色的原因是石蜡油挥发
D.若小试管中的液体是溴水,一段时间后会观察到其褪色并分层
科目:高中化学 来源: 题型:
【题目】CuAlO2是重要化工品,(NH4)2Fe(SO4)2·6H2O(摩尔盐)是化学上常用的分析试剂。某小组以黄铜矿(主要成分是CuFeS2,含少量SiO2)为原料制备这两种化工品,流程如图:
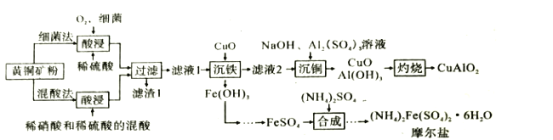
已知:①几种氢氧化物的开始沉淀和完全沉淀的pH,如表所示。
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀/pH | 4.7 | 7.6 | 2.7 |
完全沉淀/pH | 6.7 | 9.6 | 3.7 |
②4CuO+4Al(OH)3![]() 4CuAlO2+6H2O+O2↑
4CuAlO2+6H2O+O2↑
回答下列问题:
(1)CuAlO2中铜的化合价为__;滤渣1的主要成分是__(填化学式)。
(2)反应物中铁元素被氧化的目的是__。
(3)提高这两种方案中“酸浸”反应速率都需要加热,但温度都不宜过高,其原因是__。
(4)在混酸法中,CuFeS2溶于混酸生成Cu2+,Fe3+,SO42-和一种无色气体,该气体遇空气迅速变为红棕色。写出CuFeS2与混酸反应的离子方程式__。
(5)评价上述流程,补充完整:
优点 | 缺点 | |
细菌法 | ①__ | 化学反应慢,需要时间长 |
混酸法 | 节省时间 | ②___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如下。
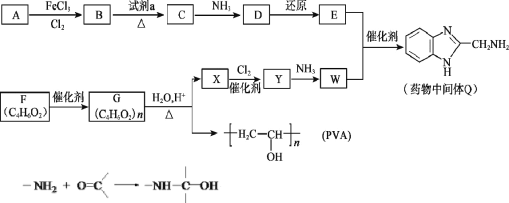
已知:
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)F含有的官能团是________。
(5)F的含有碳碳双键和酯基的同分异构体有_____种(含顺反异构体,不含F),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是___.
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
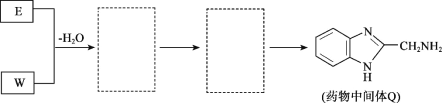
(8)将下列E+W→Q的流程图补充完整(在虚线框内写出物质的结构简式):_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述错误的是( )
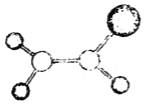
A.该有机物的分子式可能为C2HCl3
B.该有机物分子中的所有原子在同一平面上
C.该有机物无相同官能团同分异构体
D.该有机物可以和氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O2CrO42﹣(黄色)+2H+.已知Cr2O72﹣有强氧化性,而CrO42﹣则几乎没有氧化性,Cr3+呈绿色。向K2Cr2O7溶液中加入以下物质,关于溶液颜色变化的说法不正确的是( )
A.加70%的硫酸,溶液变橙色
B.加30%NaOH溶液,溶液变黄色
C.加70%的硫酸后再加C2H5OH,溶液可变成绿色
D.加30%NaOH溶液后,溶液变黄色,加C2H5OH无变化,再加过量硫酸,溶液仍无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硫是高中化学学习的两种重要非金属元素
(1)下列C原子的电子排布式表达的状态中能量最高的是_____。
A 1s22s22p2 B.1s22s22px12py1 C.1s22s22px12pz1 D.1s22s12px12py12pz1
(2)硫有一种结构为![]() 的分子(灰球代表硫原子)。其中硫原子杂化方式为_____。
的分子(灰球代表硫原子)。其中硫原子杂化方式为_____。
(3)Fe(CO)5可用作催化剂、汽油抗爆剂等,其分子中σ键和π键的数目之比为_____。
(4)已知CS2晶体结构类似于干冰。CS2晶体中与每个CS2分子距离最近且等距的CS2分予有_____个。推测CS2晶体密度与冰的晶体密度较大的为_____。可能的原因是_____。又知CS2晶体中晶胞参数是apm,NA表示阿佛加德罗常数的值,晶体密度为_____g/cm3(用含a、NA等符号的表达式表示)。
(5)Na2S是高子晶体,其晶格能可通过图的Born﹣Haber循环计算得到。
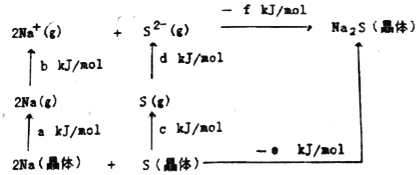
由此可知,Na原子的第一电离能为_____kJ/mol,Na2S的晶格能为_____kJ/mol。(用图中给出的符号作答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍。下列叙述正确的是
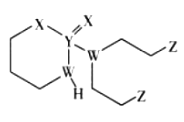
A.元素的非金属性:W>Z>X
B.Y的最高价氧化物的水化物是强酸
C.W的最简单氢化物与Z的单质混合后可产生白烟
D.Y、Z形成的化合物中,每个原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)可用于陶瓷、固体整流器,可用下列反应制备:2(CuSO4H2O)![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为________________。上述反应中,电负性最大的元素是________________(填元素符号)
(2)元素Cu和Ni相邻,其第一、二电离能数据如表所示:
I1/(kJ/mol) | I2/(kJ/mol) | |
Ni | 737.1 | 1753.0 |
Cu | 745.5 | 1957.9 |
铜的第一、二电离能都比镍对应的高,其原因除了铜的核电荷数比多,对外电子的吸外力大外,还有一个原因是________。
(3)已知H2SO4的结构式如图所示,上述反应中:

①在上述产物中,VSEPR模型与SO42-相同的是________(填化学式)
②SO3分子的立体构型是________________,写出一种与SO3互为等电子体的离子:________(填离子符号)
(4)Cu2+、Cu+与CN-、OH-、NH3、H2O等组成多种配离子。[Cu(NH3)4]2+中的Cu2+配位数为________。
(5)铜元素和氧元组成一种晶体M,M的晶胞如图所示。

已知:NA是阿伏加德罗常数的值,M晶体密度为dgcm-3。M的晶胞中Cu+、Cl-个数比为________,晶胞参数为________pm(用含d和NA的代数式表示)。(用含d和NA的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com