
【题目】NA是阿伏伽德罗常数的值。下列说法错误的是( )
A.常温常压下,40gSO3含原子总数为2NA
B.1mol铜锌合金与足量稀硝酸反应转移电子数为2NA
C.1L1molL-1CH3COONH4中性溶液含NH4+数目为NA
D.1mol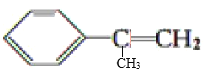 分子中最多共平面的碳原子数为9NA
分子中最多共平面的碳原子数为9NA
科目:高中化学 来源: 题型:
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
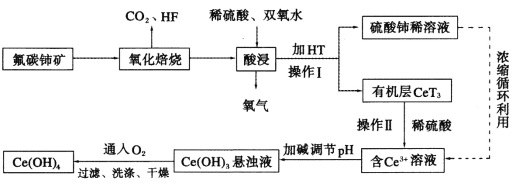
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。
回答下列问题:
(1)CeFCO3中Ce的化合价为___________________。
(2)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为_______。为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小。其原因是___。
(3)HT是一种难溶于水的有机溶剂,它能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层)![]() CeT3(有机层)+3H+(水层)。操作I的名称是_________操作Ⅱ加入稀H2SO4的目的是______。
CeT3(有机层)+3H+(水层)。操作I的名称是_________操作Ⅱ加入稀H2SO4的目的是______。
(4)向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
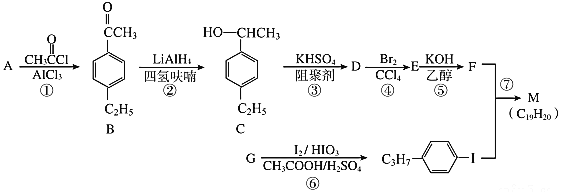
【题目】化合物M是一种常用的液晶材料。以苯的同系物A、G为原料合成M的一种路线(部分反应条件略去)如下:
已知:![]() +H—C≡C—H→
+H—C≡C—H→![]() +HI
+HI
回答下列问题:
(1)M的结构简式为________ ,A的名称为___________。
(2)D中官能团的名称是________。
(3)②的反应类型是_________,⑥的反应类型是___________。
(4)⑤的化学方程式为_______________。
(5)满足以下条件的B的同分异构体有_______________种(不考虑立体异构)。
①能与氯化铁溶液发生显色反应;②苯环上只有两个取代基;③除苯环以外没有其它环状结构
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:_______________[示例:CH3CH2OH
的合成路线:_______________[示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br]
BrCH2CH2Br]
查看答案和解析>>
科目:高中化学 来源: 题型:
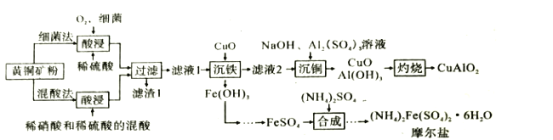
【题目】CuAlO2是重要化工品,(NH4)2Fe(SO4)2·6H2O(摩尔盐)是化学上常用的分析试剂。某小组以黄铜矿(主要成分是CuFeS2,含少量SiO2)为原料制备这两种化工品,流程如图:
已知:①几种氢氧化物的开始沉淀和完全沉淀的pH,如表所示。
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀/pH | 4.7 | 7.6 | 2.7 |
完全沉淀/pH | 6.7 | 9.6 | 3.7 |
②4CuO+4Al(OH)3![]() 4CuAlO2+6H2O+O2↑
4CuAlO2+6H2O+O2↑
回答下列问题:
(1)CuAlO2中铜的化合价为__;滤渣1的主要成分是__(填化学式)。
(2)反应物中铁元素被氧化的目的是__。
(3)提高这两种方案中“酸浸”反应速率都需要加热,但温度都不宜过高,其原因是__。
(4)在混酸法中,CuFeS2溶于混酸生成Cu2+,Fe3+,SO42-和一种无色气体,该气体遇空气迅速变为红棕色。写出CuFeS2与混酸反应的离子方程式__。
(5)评价上述流程,补充完整:
优点 | 缺点 | |
细菌法 | ①__ | 化学反应慢,需要时间长 |
混酸法 | 节省时间 | ②___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某常见金属的结晶水化合物MCl3·6H2O有如下转化关系:下列推断正确的是( )
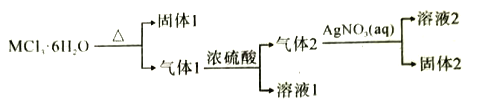
A.固体1一定是既能与盐酸反应,又能与强碱反应
B.气体1通过五水硫酸铜晶体,固体变蓝色
C.常温下,溶液2能溶解铜
D.固体2浊液中滴加Na2S溶液,白色固体变黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是重要的化工原料。
(1)利用H2S制备H2.已如:在较低温度下发生下列反应:
①H2S(g)+H2SO4(aq)═S(s)+SO2(g)+2H2O(1) △H1=+61kJmol-1
②SO2(g)+I2(s)+2H2O(1)═2HI(aq)+H2SO4(aq) △H2=-151kJmol-1
③2HI(aq)H2(g)+I2(s) △H3=+110kJmol-1
④H2S(g) H2(g)+S(s) △H4=__kJmol-1。
(2)乙烯是合成食品外包装材料一聚乙烯的单体。工业上利用H2和CO2可以制备乙烯,2CO2(g)+6H2(l)C2H4(g)+4H2O(g) △H
①在2L恒容密闭容器中投入4molCO2和amolH2,在某催化剂作用下发生上述反应,CO2的转化率与温度关系如图1所示。
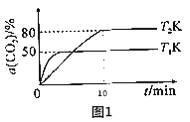
由图1判断,T2__T1(填“>”、“<”或“=”);T2K下,0~10min内H2的平均反应速率v(H2)=__molL-1min-1。
②测得单位时间内C2H4产率与温度、投料比![]() 关系如图2所示。
关系如图2所示。
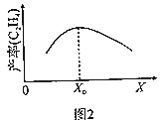
若X为温度,当温度高于X0时,单位时间内乙烯产率降低的原因可能是__。
若X为投料比,当![]() 大于X0时,乙烯产率降低的原因可能是__。
大于X0时,乙烯产率降低的原因可能是__。
③在某温度下达到平衡后,在t0时只改变一个外界条件,反应速率(v)与时间(t)的关系如图3所示。改变的条件可能是___(填字母)。

A.增大反应物浓度
B.增大压强
C.升高温度
D.加入高效催化剂
(3)科学家已研究出生物酶,利用原电池原理在常温和生物酶作用下N2和H2合成NH3,即H2在负极上发生氧化反应,H+通过质子交换膜迁移到正极区,正极上合成NH3。正极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种清洁能源,又是一种化工原料,在国民经济中发挥着重要的作用。
(1)氢气是制备二甲醚的原料之一,可通过以下途径制取:
Ⅰ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H
Ⅱ.2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) △H
已知:①CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=akJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2=bkJmol-1
③CH3OCH3(g)+H2O(g)2CH3OH(g) △H3=ckJmol-1
则反应Ⅱ的△H____kJmol-1
(2)氢气也可以和CO2在催化剂(如Cu/ZnO)作用下直接生成CH3OH,方程式如下CO2(g)+3H2(g)CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,相同时间段内测得CH3OH的体积分数φ (CH3OH)与温度(T)的关系如图所示:
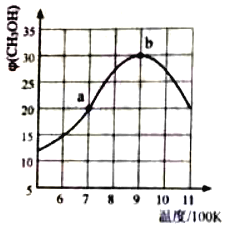
①经过10min达到a点,此时CH3OH的体积分数为20%.则v(H2)=___(保留三位小数)。
②b点时,CH3OH的体积分数最大的原因是___。
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,则反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×体积分数)
④a点和b点的v逆,a__b(填“>”“<”或”=”)若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,达平衡后φ(CH3OH)___30%。
⑤在900K及以后,下列措施能提高甲醇产率的是____(填字母)
a.充入氦气 b.分离出H2O c.升温 d.改变催化剂
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)N2(g)+2H2O(g),该反应速率表达式v=kc2(NO)c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:
i.2NO(g)+H2(g)N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)2H2O(g)△H2化学总反应分多步进行,反应较慢的一步控制总反应速率,上述两步反应中,正反应的活化能较低的是___(填“i”或“ii”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O2CrO42﹣(黄色)+2H+.已知Cr2O72﹣有强氧化性,而CrO42﹣则几乎没有氧化性,Cr3+呈绿色。向K2Cr2O7溶液中加入以下物质,关于溶液颜色变化的说法不正确的是( )
A.加70%的硫酸,溶液变橙色
B.加30%NaOH溶液,溶液变黄色
C.加70%的硫酸后再加C2H5OH,溶液可变成绿色
D.加30%NaOH溶液后,溶液变黄色,加C2H5OH无变化,再加过量硫酸,溶液仍无明显变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com