
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·L-1·s-1B. v(B)=0.3mol·L-1·s-1
C. v(C)=0.8mol·L-1·s-1D. v(D)=30mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Na与水反应:Na+H2O=Na++OH-+H2↑
B. 明矾净水原理:Al3++3H2O= Al(OH)3↓+3H+
C. 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞的原因:SiO2+2OH-=SiO32-+H2O
D. Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+= Fe 3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在“H2A-HA--A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )

A. Ka1(H2A)=10-2、Ka2(H2A)=10-5
B. pH=6时,c(HA-)∶c(A2-)=1∶10
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)操作II中加入H2O2的目的__________________________________
(4)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(5)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe元素化合物的物质的量为___________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.5 mol Cu与足量的S反应转移电子数为![]()
B. 在粗铜精炼的实验中,阳极质量减小6.4g,则电解过程中转移电子数为0.2![]()
C. 2 g D2O和H218O的混合物中含有的中子数为![]()
D. 46 g 有机物C2H6O中含有极性共价键的数目一定为7![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)可作为新型汽车动力燃料,以下是甲醇在工业上的制备过程:

请回答下列问题:
(1)在一定条件下反应室Ⅰ中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
(2)在容积不变的条件下,不能说明反应室Ⅰ中的反应已达到平衡状态的是____(选填字母标号)
a.CO的物质的量不在改变 b.容器内的压强保持不变
c.CH4的消耗速率与生成速率相等 d.容器内的密度保持不变
(3)在容积为1L反应室Ⅱ中充入1molCO与2molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
(4)氢氧燃料电池的反应原理示意图如图所示。
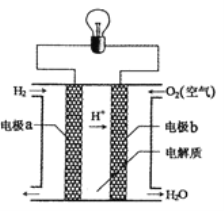
该电池中电极b是_____(填“正极”或“负极”),其电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1—18号元素中,选择合适的选项回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
【1】写出①和②的非金属性较强的是( )
A. 前者大B. 后者大C. 相等D. 无法比较
【2】写出④的最高价氧化物化学式( )
A. ROB. R2OC. R2O3D. RO2
【3】写出③和⑤的最高价氧化物对应水化物反应的离子方程式( )
A. 2NaOH+H2SO4=Na2SO
C. NaOH+H2SO4=Na2SO4+H2OD. 2OH- +H2SO4=SO42- +2H2O
【4】③和④两种元素的最高价氧化物对应水化物中碱性较强的是
A. 前者大B. 后者大C. 相等D. 无法比较
【5】写出③的单质在②单质中燃烧的现象()
A. 白色固体B. 淡黄色固体C. 浅紫色火焰D. 苍白色火焰
【6】①元素在周期表中的位置是( )
A. 第二周期第四主族B. 第二周期第IV主族
C. 第二周期第IVA族D. 第二周期第VA族
【7】②和⑤两种元素中原子半径较大的是( )
A. 前者大B. 后者大C. 相等D. 无法比较
【8】下列化学用语表达不正确的是( )
A. 氟离子的结构示意图: ![]() B. 水分子的电子式:
B. 水分子的电子式:![]()
C. 二氧化碳的结构式:O=C=OD. 硫酸钠的电离方程式:Na2SO4=2Na++SO42-
【9】⑤和⑥形成的气态氢化物最稳定的是( )
A. 前者大B. 后者大C. 相等D. 无法比较
【10】④的氧化物类型为 ( )
A. 酸性氧化物,非金属氧化物B. 两性氧化物,金属氧化物
C. 碱性氧化物,金属氧化物D. 酸性氧化物,金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组制备硫代硫酸钠晶体![]() 的实验装置如下图所示(省略夹持装置):
的实验装置如下图所示(省略夹持装置):

主要实验步骤为:①检查装置气密性,按图示加入试剂;②先向C中烧瓶加入![]() 和
和![]() 混合溶液,再向A中烧瓶滴加浓硫酸;③待
混合溶液,再向A中烧瓶滴加浓硫酸;③待![]() 和
和![]() 完全消耗后,结束反应。过滤C中混合物,滤液经一系列实验操作后得到产品。
完全消耗后,结束反应。过滤C中混合物,滤液经一系列实验操作后得到产品。
已知:i![]() 是无色透明晶体,易溶于水,其稀溶液与
是无色透明晶体,易溶于水,其稀溶液与![]() 溶液混合无沉淀生成;ii向
溶液混合无沉淀生成;ii向![]() 和
和![]() 混合溶液中通入
混合溶液中通入![]() 可制得
可制得![]() 所得产品常含有少量
所得产品常含有少量![]() 和
和![]() 。
。
回答下列问题:
(1)仪器a的名称是____________;B、D装置的作用是_____________。
(2)上述实验步骤③中的操作主要有_______________、冷却结晶、过滤、洗涤、干燥;E中的试剂是_____________。
(3)为检验产品中是否含有![]() 和
和![]() ,该小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整:
,该小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整:
取适量产品配成稀溶液,滴加足量![]() 溶液,有白色深沉生成,向沉淀中滴加足量的_________,若____________(填实验现象),则可以确定产品中含有
溶液,有白色深沉生成,向沉淀中滴加足量的_________,若____________(填实验现象),则可以确定产品中含有![]() 和
和![]() 。
。
(4)为减少装置C中生成![]() 的量,在不改变原有装置的基础上对实验步骤②需进行改进,具体操作是_________________;写出制备
的量,在不改变原有装置的基础上对实验步骤②需进行改进,具体操作是_________________;写出制备![]() 的总反应的化学方程式:___________________________。
的总反应的化学方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com