
| n |
| V |
| 7.6g |
| 152g/mol |
| 0.05mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、向 NaHS 溶液中通入适量氯气:HS-+Cl2=S↓+H++2Cl- |
| B、向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、将 10 mL 0.1 mol?L-1HCl溶液与20 mL 0.05 mol?L-1 Na3PO4溶液混合3H++2 PO43-=H2PO4-+HPO42- |
| D、向 Mg(HCO3)2溶液中加入过量NaOH 溶液Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫氰化钾溶液:Na+、Cl-、SO42-、Fe3+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、ClO-、Cl- |
| C、氢氧化钠溶液:K+、Ba2+、Cl-、Br- |
| D、碳酸钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g金属镁变成镁离子时失去的电子数目为0.1 NA |
| B、标准状况下,2.24L水所含的分子数为0.1 NA |
| C、OH-中含有电子数为10NA |
| D、71g氯气与过量的铁粉完全反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.89过氧化钠中含有的离子数为0.4NA |
| B、将0.1molFeCl3水解制成胶体,所得胶体粒子数为0.1NA |
| C、等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等 |
| D、常温常压下28 g CO与22.4 L O2所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ |
| B、盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ |
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| D、NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 同学们为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.2mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
同学们为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.2mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验 编号 |
温度(K) | 盐酸浓度 (mol?L-1) |
醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | / | a.实验①和②是探究 b.实验①和③是探究 c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. |
| ② | 308 | 0.20 | / | |
| ③ | 298 | 0.40 | / | |
| ④ | 0.20 | / |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
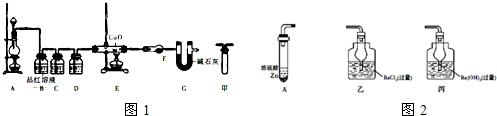
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com