
【题目】肼(N2H4)是一种重要的液态火箭燃料,具有弱碱性和强还原性.工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4H2O)、Na2CO3等产物.请回答:
(1)上述生成水合肼的反应中尿素是________( 填“氧化剂”或“还原剂”),反应的化学方程式为________.
(2)肼与盐酸反应可生成N2H6Cl2 , N2H6Cl2的水溶液显________性( 填“酸”或“碱”或“中”),用离子方程式表示其原因________.
(3)查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜.取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在高温下恰好完全反应生成氮气等产物,写出该反应的化学方程式________.
若要设计实验方案检验上述反应生成固体产物中的金属阳离子,补充完整下列实验步骤:
①所得固体溶入浓盐酸中; ②________
【答案】 还原剂 CO(NH2)2+NaClO+2NaOH=N2H4H2O+Na2CO3+NaCl 酸 N2H62++2H2ON2H42H2O+2H+ N2H4+6Fe2O3![]() N2+4Fe3O4+2H2O 取两份待测液,一份加铁氰化钾,产生蓝色沉淀;另一份加硫氰化钾,显血红色;说明固体产物中既有亚铁离子又有铁离子
N2+4Fe3O4+2H2O 取两份待测液,一份加铁氰化钾,产生蓝色沉淀;另一份加硫氰化钾,显血红色;说明固体产物中既有亚铁离子又有铁离子
【解析】(1)尿素和次氯酸钠-氢氧化钠溶液反应生成肼、碳酸钠、氯化钠、水,该化学反应方程式为CO(NH2)2+NaClO+2NaOH=N2H4H2O+Na2CO3+NaCl,该反应中:CO(NH2)2中N(-3)→N2H4H2O中N(-2)为还原剂,NaClO中Cl(+1→-1)为氧化剂,故答案为:还原剂;CO(NH2)2+NaClO+2NaOH=N2H4H2O+Na2CO3+NaCl;
(2)N2H6C12为强酸弱碱盐,水解呈酸性,水解方程式为:N2H62++2H2ON2H42H2O+2H+,故答案为:酸;N2H62++2H2ON2H42H2O+2H+;
(3)肼与氧化铁在高温条件下反应生成氮气、水、铁单质,方程式为:3N2H4+2Fe2O3![]()
3N2+4Fe+6H2O,故答案为:3N2H4+2Fe2O3![]() 3N2+4Fe+6H2O;
3N2+4Fe+6H2O;
②铁与盐酸反应生成氯化铁和氢气,离子方程式为Fe+2H+═Fe2++H2↑,检验亚铁离子,双氧水能氧化亚铁离子生成铁离子,铁离子能与硫氰化钾反应生成血红色物质,故答案为:Fe+2H+═Fe2++H2↑;先加入双氧水、再加硫氰化钾。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体是( )
A. 金属晶体 B. 离子晶体 C. 分子晶体 D. 原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子浓度都为0.1 mol·L-1的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是( )
A. 在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B. 在含I-、SO![]() 、Br-的溶液中不断通入氯气:I-、Br-、SO
、Br-的溶液中不断通入氯气:I-、Br-、SO![]()
C. 在含AlO![]() 、CO
、CO![]() 、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO
、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO![]() 、CO
、CO![]()
D. 在含Fe3+、H+、NH![]() 的溶液中逐渐加入烧碱溶液:H+、NH
的溶液中逐渐加入烧碱溶液:H+、NH![]() 、Fe3+
、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验:
Ⅰ.查阅资料
①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
②2Na2S2O4+4HCl===4NaCl+S↓+3SO2↑+2H2O;
Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O。
Ⅱ.制备方法
75 ℃时将甲酸钠和纯碱加入乙醇溶液中,通入SO2进行反应,完成其反应的化学方程式:
________HCOONa+________Na2CO3+________===________Na2S2O4+________CO2+______
冷却至40~50 ℃,过滤,用________洗涤,干燥制得Na2S2O4。
Ⅲ.Na2S2O4的性质
(1)Na2S2O4溶液在空气中易被氧化。课题小组测定0.050 mol·L-1 Na2S2O4溶液在空气中pH变化如图所示:
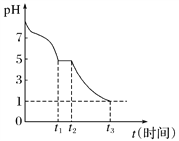
0~t1段主要生成HSO![]() ,根据pH变化图,HSO
,根据pH变化图,HSO![]() 的电离程度________(填“<”或“>”)水解程度。
的电离程度________(填“<”或“>”)水解程度。
0~t1段发生反应的离子方程式为_____________。
t3时溶液中存在的主要阴离子的符号是_________________。
(2)隔绝空气加热Na2S2O4固体完全分解;得到固体产物Na2SO3、Na2S2O3和________(填化学式)气体。
请你设计实验验证产物有Na2S2O3存在,完成下表中内容。
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
______ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中氧化还原反应的离子方程式为__________,溶解温度应控制在60~70℃,原因是______。
(2)写出步骤③中主要反应的离子方程式__________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是__________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是__________。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amoI/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+。样品中CuCl的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7 种物质,①甲烷②苯③2一丁炔④环己烷⑤邻二甲苯⑥环己烯⑦二氧化硫,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A. ③⑥⑦ B. ②④⑥⑦ C. ②⑤⑥⑦ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )

A. 该金属腐蚀过程为析氢腐蚀
B. 正极为C,发生的反应为氧化反应
C. 在酸性条件下发生的是吸氧腐蚀
D. 正极反应为O2+2H2O+4e-===4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com