
【题目】解释下列事实的方程式正确的是
A. 向Na2SiO3溶液中通入过量CO2:SiO32-+ CO2+ H2O= H2SiO3(胶体)+ CO32-
B. 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C. 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D. 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32﹣+Ca2+=CaCO3↓
【答案】C
【解析】A.向Na2SiO3溶液中通入过量CO2生成 H2SiO3(胶体)和NaHCO3,且HCO3-不可拆分,故A错误;B.醋酸是弱酸,不可拆分,故B错误;C.煤中加入石灰石可减少煤燃烧时SO2的排放是碳酸钙分解生成的氧化钙和二氧化硫反应生成亚硫酸钙,在空气中氧化为硫酸钙,反应的化学方程式2CaCO3+O2+2SO2═2CO2+2CaSO4,故C正确;D.酸式盐和碱反应量少的全部反应,离子方程式中符合化学式组成比,碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀反应的离子方程式:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故D错误;故选C。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
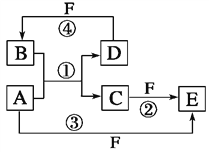
(1)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,写出反应②离子方程式是______________________________________,
已知光照条件下D与F反应生成B,写出该反应的化学方程式为__________________________。
(2)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对于杂质(括号中的物质为杂质)的检验和除杂方法均正确的是( )
选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
B | NaCl(NH4Cl) | 加热 | 加热 |
C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1 , 则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量57.3kJ.(填>,<或=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、蛋白质、油脂和纤维素的说法中,正确的是( )
A.它们的组成中都有C、H、O、N等元素
B.在一定条件下,它们都能发生水解反应
C.人体需要的二十多种氨基酸都可以通过人体自身合成
D.油脂都是高级脂肪酸甘油酯,是一种高热量营养素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有0.1 mol·L-1Na2SO4溶液300mL,0.1 mol·L-1MgSO4溶液200mL和0.1 mol·L-1Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是
A. 1︰1︰1 B. 3︰2︰1 C. 1︰1︰3 D. 3︰2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为____________________________________________________。
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是___________________,原子半径由大到小的顺序是__________________。
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ![]() C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是_______(填序号),既有离子键又有非极性键的是______(填序号);既有离子键又有极性键的是______(填序号)。
(5)下列原子:![]() 中共有____种元素,__种核素。
中共有____种元素,__种核素。
(6)写出下列物质或微粒的电子式:
①CO2__________②KCl_____________③H2O2_______________④N2_____________;
⑤用电子式表示MgCl2的形成过程_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4![]() H2O):
H2O):![]()
NaClO过量时,易发生反应:![]()
实验一:制备NaClO溶液(实验装置如图甲所示)

锥形瓶中发生反应的离子方程式是__________________。
实验二:制取水合肼(实验装置如图乙所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分。
分液漏斗中的溶液是_____________(填序号);
A、CO(NH2)2溶液 B、NaOH溶液 C、NaOH和CO(NH2)2混合溶液 D、NaOH和NaClO混合溶液
选择的理由是_________________。
实验三:测定馏分中肼含量
称取馏分5.000g加入适量NaHCO3固体,加入配成250mL溶液,移出25.00mL,用0.1000mol/L的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右(已知:N2H4![]() H2O+2I2═N2↑+4HI+H2O)。
H2O+2I2═N2↑+4HI+H2O)。
配制250mL溶液所需仪器除分析天平、烧杯、玻璃棒外,还需______________。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因:__________。
实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4![]() H2O)的质量分数为____________。
H2O)的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学与生活密切相关,下列说法不正确的是 _________
A. 抗酸药能中和胃里过多的盐酸,缓解胃部不适
B. 柠檬因为有酸味,所以属于酸性食品
C. 目前加碘食盐中碘元素以KIO3形式存在
D. 利用油脂在碱性条件下的水解,可以制甘油和肥皂
(2)化学与生活息息相关。下列叙述正确的是 _________
A. 土豆的淀粉经水解可变成酒 B. 油脂经水解可变成葡萄糖
C. 鲜榨橙汁遇到碘水会变蓝 D. 馒头越嚼越甜
(3)纤维素被称为“第七营养素”。食物中的纤维素虽然不能被消化,但能刺激肠道蠕动和分泌消化液,有助于食物的消化和废物的排泄。在化学分类中,纤维素属于_________
A.蛋白质 B.脂肪 C.多糖
(4)某种食品的配料标签如图所示:

①其中,富含蛋白质的物质是______,富含油脂的物质是______,有防腐作用的是______。
②用于包装该食品的聚乙烯塑料包装属于______(填字母)。
A.有机高分子材料 B.无机非金属材料 C.金属材料
③大量使用塑料包装,会造成“____污染”,这种包装袋属于______(可回收资源 / 不可回收资源)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com