
【题目】FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,请写出反应的离子方程式____________________________.
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐,是城市污水及工业废水处理的高效絮凝剂.实验室制取氢氧化铁胶体的方法是______(填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为______。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下: FeCl3+ KI= FeCl2+ I2+ KCl,配平上述反应方程式,并在上式上用双线桥法标出该反应电子转移的方向和数目。________
(4)向(3)反应后的溶液中加入CCl4溶液,振荡、静置后会发现_____层(填“上”或“下”)液体的颜色为______色,再将混合液倒入______(填仪器名称)中,将两层液体分离。
【答案】2Fe3++Cu=2Fe2++Cu2+ C 丁达尔效应 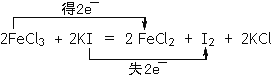 下 紫(或紫红) 分液漏斗
下 紫(或紫红) 分液漏斗
【解析】
(1)FeCl3溶液与铜反应生成氯化铜和氯化亚铁;(2)FeCl3在沸水中可生成胶体,胶体具有丁达尔效应;(3)根据化合价升降守恒配平方程式,反应中,Fe元素的化合价降低,I元素的化合价升高,以此分析电子转移;(4)向(3)反应后的溶液中加入CCl4溶液,发生萃取,四氯化碳的密度大于水。据此分析解答。
(1)FeCl3溶液作为“腐蚀液”腐蚀铜板,生成CuCl2和FeCl2,该离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)实验室制取氢氧化铁胶体的方法为将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体,则应选C,且胶体具有丁达尔效应,可利用此性质来证明此胶体已经制成,故答案为:C;丁达尔效应;
(3) FeCl3+ KI= FeCl2+ I2+ KCl中,Fe元素的化合价由+3价降低为+2价,I元素的化合价由-1价升高到0价,根据化合价升降守恒配平得:2FeCl3+2KI=2FeCl2+I2+2KCl电子转移的方向和数目可以表示为 ,故答案为:
,故答案为: ;
;
(4)向(3)反应后的溶液中加入CCl4溶液,发生萃取,有机层在下层,颜色为紫色(或紫红色),然后利用分液漏斗分离,故答案为:下;紫(或紫红);分液漏斗。


科目:高中化学 来源: 题型:
【题目】(1)某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题:
①写出酸性KMnO4溶液和H2C2O4的离子方程式___________________________________。
②配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________________________________。
③将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
先滴入第1滴 | 60s |
褪色后,再滴入第2滴 | 15s |
褪色后,再滴入第3滴 | 3s |
褪色后,再滴入第4滴 | 1s |
请分析KMnO4溶液褪色时间变化的可能原因___________________________________。
(2)![]() 和
和![]() 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中![]() 随c(H+)的变化如图所示
随c(H+)的变化如图所示

①用离子方程式表示溶液中![]() 和
和![]() 的转化反应_________。
的转化反应_________。
②由图可知,溶液酸性减小, ![]() 的平衡转化率_________(填“增大”“减小”或“不变”)。
的平衡转化率_________(填“增大”“减小”或“不变”)。
③升高温度,溶液中![]() 的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一容积为1L的密闭容器中,加入0.4 mol的N2和1.2 mol的H2,在一定条件下发生如下反应:N2(B)+3H2(g)![]() 2NH3(g) △H<0,5min 时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:
2NH3(g) △H<0,5min 时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:

请回答下列问题:
(1) 根据如图,计算从反应开始到平衡时,平均反应速率v(N2)=_________。
(2) 该反应的化学平衡常数表达式为__________________。
(3) 反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_________(填序号)。
A.0.80mol·L-1 B.0.25mol·L-1 C.0.20mol·L-1 D.0.08mol·L-1
(4) 反应达到平衡后,第5 min末保持其他条件不变,若只把容器的体积缩小一半,平衡移动_________(填“向右”、“向左”或“不”,化学平衡常数_________( 填“增大”、“减少”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,分别将0.1molNa、Na2O、Na2O2、NaOH加入盛有100mL水(设水的密度为1g/cm3)的甲、乙、丙、丁四个烧杯中并恢复至原温度,则甲、乙、丙、丁四烧杯中溶液的质量分数大小关系为
A. 丙>乙>丁>甲 B. 丁>甲>乙>丙 C. 乙=丙>甲>丁 D. 丁>丙=乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定),且有气体剩余。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、和NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O2和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据烯烃、炔烃的命名原则,回答下列问题:
(1)有机物![]() 的系统名称为______________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为______________。
的系统名称为______________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为______________。
(2)有机物![]() 的系统名称为_____________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为_____________。
的系统名称为_____________,使其在催化剂存在条件下完全氢化,所得烷烃的系统名称为_____________。
(3)有机物2-甲基-2-戊烯的结构简式为_________。
(4)某烯烃的错误命名是2-甲基-4-乙基-2-戊烯,则它的正确命名是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①![]() ②
② ③CH4 ④
③CH4 ④  ⑤
⑤![]()
⑥

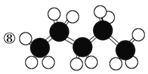

⑩
(1)上述表示方法中属于结构简式的为__________;
属于结构式的为________;
属于键线式的为________;
属于比例模型的为________;
属于球棍模型的为________。
(2)写出⑨的分子式:________。
(3)写出⑩中官能团的电子式:________、________。
(4)②的分子式为________,最简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①_____________________________________;②_______________________________________。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.玻璃棒用作引流 b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:

(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为有色溶液),下层_____色。

Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

(1)欲证明滤液中存在SO42-、OH -,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH - 均存在。
(2)如何洗涤Mg(OH)2沉淀?___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com