
【题目】有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①![]() ②
② ③CH4 ④
③CH4 ④  ⑤
⑤![]()
⑥

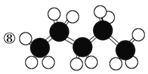

⑩
(1)上述表示方法中属于结构简式的为__________;
属于结构式的为________;
属于键线式的为________;
属于比例模型的为________;
属于球棍模型的为________。
(2)写出⑨的分子式:________。
(3)写出⑩中官能团的电子式:________、________。
(4)②的分子式为________,最简式为________。
科目:高中化学 来源: 题型:
【题目】如图装置,放电时可将Li、CO2转化为Li2CO3和C,充电时选用合适催化剂仅使Li2CO3转化为Li、CO2和O2。下列有关表述正确的是

A. 放电时,Li+向电极X方向移动
B. 充电时,电极Y应与外接直流电源的负极相连
C. 充电时,阳极的电极反应式为C+2Li2CO3-4e-===3CO2↑+4Li+
D. 放电时,每转移4mol电子,生成1molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,请写出反应的离子方程式____________________________.
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐,是城市污水及工业废水处理的高效絮凝剂.实验室制取氢氧化铁胶体的方法是______(填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为______。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下: FeCl3+ KI= FeCl2+ I2+ KCl,配平上述反应方程式,并在上式上用双线桥法标出该反应电子转移的方向和数目。________
(4)向(3)反应后的溶液中加入CCl4溶液,振荡、静置后会发现_____层(填“上”或“下”)液体的颜色为______色,再将混合液倒入______(填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
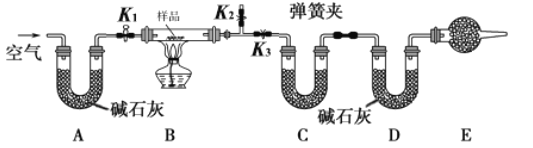
(1)请将实验步骤补充完整
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 _____________________。
②称取样品,并将其放入硬质玻璃管中;并称量C、D装置的质量。
③打开活塞K1和K2,关闭K3,缓慢鼓入空气数分钟,其目的是____________________。
④关闭活塞K1和K2,打开K3,点燃酒精灯加热至不再产生气体。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后卸下装置,再次称量C、D装置的质量。
(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对NaCl测定结果的影响是___________(“偏高”、“偏低”或“无影响”)
②E处干燥管中盛放的药品是_______________,其作用是_____________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数______________(“偏高”、“偏低”或“无影响”)
③若样品质量为wg,反应后C、D装置增加的质量分别为m1g和m2g,由此可知混合物中Na2CO3·10H2O的质量分数为______(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物只含有C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该有机物的结构简式为___________。
(2)该有机物中所含官能团的名称为___________。
(3)下列物质中,与该有机物互为同系物的是___________(填序号,下同),互为同分异构体的是___________。
①CH3CH=CHCOOH ②CH2=CHCOOCH3
③CH3CH2CH=CHCOOH ④(CH3)2CHCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
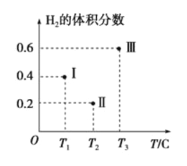
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_____________。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________。
②需“密闭保存”的原因____________________________________________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:如下:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:

回答下列问题:
(1)“碱浸”时发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,________________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。___________________________
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为__________________。
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其放电时,正极的电极反应式为__________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com