
【题目】相同温度下,分别将0.1molNa、Na2O、Na2O2、NaOH加入盛有100mL水(设水的密度为1g/cm3)的甲、乙、丙、丁四个烧杯中并恢复至原温度,则甲、乙、丙、丁四烧杯中溶液的质量分数大小关系为
A. 丙>乙>丁>甲 B. 丁>甲>乙>丙 C. 乙=丙>甲>丁 D. 丁>丙=乙>甲
【答案】C
【解析】
钠、氧化钠、过氧化钠和水反应的方程式分别如下:2Na+2H2O=2NaOH+H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;2Na2O2+2H2O=4NaOH+O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量=0.1mol×40g/mol=4g;所以溶液增加的质量大小顺序为:钠<氢氧化钠<氧化钠=过氧化钠,根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol、0.1mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得溶液的质量分数分别为:![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%,所以甲、乙、丙、丁的质量分数大小的顺序是:乙=丙>甲>丁,故选C。
×100%,所以甲、乙、丙、丁的质量分数大小的顺序是:乙=丙>甲>丁,故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图装置,放电时可将Li、CO2转化为Li2CO3和C,充电时选用合适催化剂仅使Li2CO3转化为Li、CO2和O2。下列有关表述正确的是

A. 放电时,Li+向电极X方向移动
B. 充电时,电极Y应与外接直流电源的负极相连
C. 充电时,阳极的电极反应式为C+2Li2CO3-4e-===3CO2↑+4Li+
D. 放电时,每转移4mol电子,生成1molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(![]() )的结构与性质的叙述不正确的是( )
)的结构与性质的叙述不正确的是( )
A. 分子中有三种化学环境不同的氢
B. 在光照下与Cl2反应生成的一氯取代产物主要是: ![]()
C. 在一定条件下与HCl反应的加成产物可能有两种
D. 与分子式为C6H12的有机物互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下8种化合物中,不能通过化合反应直接生成的有
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④Cu2(OH)2CO3 ⑤Al(OH)3 ⑥Na2CO3 ⑦NaHCO3 ⑧Na2O2
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是()。

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液显色
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,请写出反应的离子方程式____________________________.
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐,是城市污水及工业废水处理的高效絮凝剂.实验室制取氢氧化铁胶体的方法是______(填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为______。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下: FeCl3+ KI= FeCl2+ I2+ KCl,配平上述反应方程式,并在上式上用双线桥法标出该反应电子转移的方向和数目。________
(4)向(3)反应后的溶液中加入CCl4溶液,振荡、静置后会发现_____层(填“上”或“下”)液体的颜色为______色,再将混合液倒入______(填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
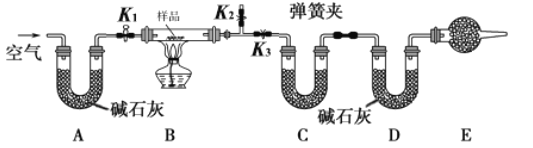
(1)请将实验步骤补充完整
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 _____________________。
②称取样品,并将其放入硬质玻璃管中;并称量C、D装置的质量。
③打开活塞K1和K2,关闭K3,缓慢鼓入空气数分钟,其目的是____________________。
④关闭活塞K1和K2,打开K3,点燃酒精灯加热至不再产生气体。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后卸下装置,再次称量C、D装置的质量。
(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对NaCl测定结果的影响是___________(“偏高”、“偏低”或“无影响”)
②E处干燥管中盛放的药品是_______________,其作用是_____________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数______________(“偏高”、“偏低”或“无影响”)
③若样品质量为wg,反应后C、D装置增加的质量分别为m1g和m2g,由此可知混合物中Na2CO3·10H2O的质量分数为______(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_____________。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________。
②需“密闭保存”的原因____________________________________________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com