
����Ŀ�����Ų��Ͽ�ѧ�ķ�չ�����������仯����õ���Խ��Խ�㷺��Ӧ�ã�������Ϊ���Ͻ��ά���ء���Ϊ�������ú�������������V2O5��VOSO4�������Բ�������������Ա����������һ�����ӽ��������շ����¹��գ������ʴ�91.7%���ϡ����ֺ���������ˮ�е��ܽ������±���ʾ��
���� | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
�ܽ��� | ���� | ���� | ���� | ���� |
�ù��յ���Ҫ�������¡�

��ش��������⣺
��1����д������Na2SO3��Һ������Ӧ�����ӷ���ʽ_________��
��2����������ʹ�õĴ�������ý(V2O5)�ܼӿ���������������ʣ��˹����в�����һ�������м��壨����ͼ��������a��c�����Ļ�ѧ����ʽ�ɱ�ʾΪ_________________��______________��
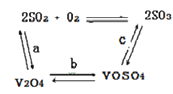
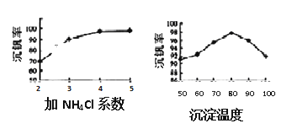
��3���ù����г������ǻ��շ��Ĺؼ�֮һ�������ʵĸߵͳ�����ҺpHӰ���⣬����Ҫ�����Ȼ��ϵ����NH4Cl������������Һ��V2O5�������ȣ����¶ȡ�������ͼ�Խ�������Ȼ��ϵ��Ϊ_________�������¶ȵķ���Ϊ_________________��
��4������Һ1����Һ2��Ϻ����������������Ԫ�ر���ԭΪ��ͼۣ��䷴Ӧ�����ӷ�Ӧ����ʽΪ___��
��5���������ط�����ã�NH4VO3�ڱ��չ����У����������ļ���ֵ�������꣩���¶ȱ仯��������ͼ��ʾ����NH4VO3�ڷֽ������_________��

A���ȷֽ�ʧȥH2O���ٷֽ�ʧȥNH3 B���ȷֽ�ʧȥNH3���ٷֽ�ʧȥH2O
C��ͬʱ�ֽ�ʧȥH2O��NH3D��ͬʱ�ֽ�ʧȥH2��N2��H2O
��6��ȫ����صĵ������ҺΪVOSO4��Һ����صĹ���ԭ��ΪVO2+ + V2++2H+ ![]() VO2+ +H2O +V3+����س��ʱ�����ĵ缫��ӦʽΪ___________��
VO2+ +H2O +V3+����س��ʱ�����ĵ缫��ӦʽΪ___________��
���𰸡�V2O5+SO32-+4H+=2VO2++SO42-+2H2O SO2+V2O5SO3+V2O4 4VOSO4+O22V2O5+4SO3 4 ����Ӧ��������80���ˮԡ�� 6 VO2++ClO3-+3 H2O=6VO2++Cl-+6 H+ B VO2+ +H2O �Ce- = VO2+ + 2H+
��������
��1������������л�ԭ�ԣ����������£��ܱ���������������������������ӣ����ӷ�Ӧ����ʽΪ��V2O5+SO32-+4H+=2VO2++SO42-+2H2O��
��2������ͼ�е�ת����ϵ��V2O5���뷴Ӧ�����������Ѷ�����������Ϊ��������������ԭΪͼ�в���V2O4������������ԭ��Ӧ��ʵ��д������ƽa����ѧ����ʽSO2+V2O5SO3+V2O4+V2O4��C��VOSO4ת��ΪSO3���˹�����Ҫ�������ɴ���V2O5����Ҫ��������ɣ��˹����е�������Ϊ���������ݻ��ϼ۵ı仯д��C����ѧ����ʽ 4VOSO4+O22V2O5+4SO3��
��3������ͼʾ�������ݣ�80��ʱ���������Ϊ98%���������¶�ʱ������ʷ������ͣ����Ȼ��ϵ��֪���Ȼ��ϵ��Խ�������Խ��ϵ��Ϊ5��Ϊ4����Щ�����Ȼ��ϵ��Խ����Ҫ���Ȼ��Խ�࣬�Ӿ��ýǶȷ��������ʣ����Լ�NH4Cl��ϵ�����Ϊ4�������¶ȵķ���Ϊ����Ӧ��������80���ˮԡ�У�
��4������Һ1����Һ2��Ϻ����������������Ԫ�ر���ԭΪ��ͼ�-1�ۣ��䷴Ӧ�����ӷ�Ӧ����ʽΪ6 VO2++ClO3-+3 H2O=6VO2++Cl-+6 H+��
��5������NH4VO3�ڱ��ձ仯��ͼ���֪��
2NH4VO3�TV2O5+2NH3��+H2O
234g 34g 18g
210��ʱ��������������ֵΪ1-85.47%=14.54%��380��ʱ��������������ֵΪ85.47-77.78%=7.69%��
���ݷ���ʽ֪������ˮʱ�����������ٷ���С�����ɰ���ʱ������210��ʱ���ٵ��ǰ�����380��ʱ���ٵ���ˮ����÷�Ӧ��������ʧȥ������ʧȥˮ����ѡB��
��6��ȫ����صĵ������ҺΪVOSO4��Һ����صĹ���ԭ��ΪVO2+ + V2++2H+ ![]() VO2+ +H2O +V3+����س��ʱ����VO2+ʧ��������VO2+����缫��ӦʽΪVO2+ +H2O �Ce- = VO2+ + 2H+��
VO2+ +H2O +V3+����س��ʱ����VO2+ʧ��������VO2+����缫��ӦʽΪVO2+ +H2O �Ce- = VO2+ + 2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ƿ�ͷ�Һ©���ڵ�Һ�����ˮ�����ձ��ڵμ�ˮʱ������U�ι���Һ���������ƣ��ָ���ԭ�¶Ⱥ�������ұ�Һ�������ƽ�����ձ��ڵ������ǣ� ��

A.��������B.�Ȼ���C.��D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ�������ͨ��X��������Ӧ��2X(g)![]() Y(g)���¶�T1��T2��X�����ʵ���Ũ��c(X)��ʱ��t�仯��������ͼ��ʾ������������ȷ����
Y(g)���¶�T1��T2��X�����ʵ���Ũ��c(X)��ʱ��t�仯��������ͼ��ʾ������������ȷ����

A. �÷�Ӧ���е�M��ų����������ڽ��е�W��ų�������
B. T2�£���0��t1ʱ���ڣ���(Y)��a-b/t1����mol/(L��min)
C. M�������Ӧ����������������N����淴Ӧ���������棩
D. M��ʱ�ټ���һ������X��ƽ���X��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ������ѧ��Ǯ��̩���ڵ���CCl4�ͽ�����Ϊԭ�ϣ���700��ʱ��Ӧ������������ʯ��ĩ����һ�ֻ�����óɹ�����������Ȩ���ġ���ѧ����־�ϣ�����ѧ���Ǹ߶�����Ϊ�����ݱ�ƽ𡱡������й�˵���У�����Ϊ������ǣ� ��
A. Na�Ļ�ԭ��ǿ�ڽ��ʯB. ��һ�ֻ�������NaCl
C. �������ʯ��ĩ��������ĤD. �����Ӧ���û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʮ�����ʣ���H2 ���� �۴��� ��CO2 ��H2SO4 ��Ba(OH)2���� �߰�ˮ ��ϡ���������Al2(SO4)3 ��NaHSO4��
(1)�����ʵķ������д����Ŀհ״���
���ڷǵ���ʵ���__________�����ڵ���ʵ���__________���ܵ������____________��
(2)����ʮ������������������֮��ɷ������ӷ�Ӧ��H++OH===H2O�������ӷ�Ӧ��Ӧ�Ļ�ѧ����ʽΪ_____________________________��
(3)д���ۺ͢߷�Ӧ�����ӷ���ʽΪ__________________��34.2 g ������ˮ���250 mL��Һ��SO42-�����ʵ���Ũ��Ϊ_________________��
(4)�����Ģ�ͨ�����Һ�з�Ӧ�����ӷ���ʽΪ______________________��
(5)�������Һ�������Һ������Һ�е�Ba2+����ǡ����ȫ����ʱ��Ӧ�����ӷ���ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. 2.3gNaͶ�뵽97.7gˮ���γ���Һ����������Ϊ2.3%
B. 25g CuSO4.5H2O����ˮ���1L��Һ�����ʵ����ʵ���Ũ��Ϊ0.1mol/L
C. Na2O2����ˮ������δ�����ı�
D. ��״���£�22.4 L��SO3������������ΪNA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ����������ľ�ķ������ȡ���ҵ�Ͽ���ʴ�̷�Һ(����һ����Cu2����H����SO42-��H2O2����Fe3��)�Ʊ��ߴ��ȼ�ʽ̼��ͭ�����Ʊ��������£�

(1)�Լ�1���ѡ��_________��
a.Fe2O3 b.CaCO3 c.CuO
(2)����Na2CO3����ǰ���ȥFe3��������Fe2(SO4)3����Na2CO3��Ӧ������һ�����壬ͬʱ����NaFe3(OH)6(SO4)2������Ӱ���Ʒ������д���÷�Ӧ�Ļ�ѧ����ʽ________________��
(3)����Na2CO3����ʱ����ӦҺpH�Բ�Ʒ��SO42-�ĺ����Լ���ӦҺ��Cu2������Ч�ʵ�Ӱ������ͼ��ʾ���ڶ��γ���ʱ��ҺpH��ÿ�����________��

(4)���Ƶõļ�ʽ̼��ͭ����ɿɱ�ʾΪ��xCuCO3��yCu(OH)2��zH2O��Ҫ�ⶨ����ɣ���ͬѧ��Ƶ�ʵ�鷽������Ҫ����������裺�ٳ�ȡ12.0�˵���Ʒ���ڸ��·ֽ⣻�۲������CO2������Ϊ2.2�ˣ��ܲ������ˮ����������Ϊ1.8�ˢݳ�������CuO������Ϊ8.0g���������ʽ̼��ͭ����ɣ�д��������̡�____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������I2O5������CO��Ⱦ����ӦΪI2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)����ͬ�¶�������װ��������I2O5�����2L�����ܱ�������ͨ��2mol CO�����CO2 �����������(CO2)��ʱ��t�仯��������ͼ������˵����ȷ����
5CO2(g)+I2(s)����ͬ�¶�������װ��������I2O5�����2L�����ܱ�������ͨ��2mol CO�����CO2 �����������(CO2)��ʱ��t�仯��������ͼ������˵����ȷ����

A. b��ʱ��CO��ת����Ϊ20%
B. �����ڵ�ѹǿ���ֺ㶨��������Ӧ�ﵽƽ��״̬
C. b���d��Ļ�ѧƽ�ⳣ����Kb>Kd
D. 0��0.5min��Ӧ����v(CO)=0.3mol��L-1��min-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com